题目内容
A、B、C、D为短周期内除稀有气体外的元素,它们的原子序数依次增大.四种元素中只有C为金属元素;A和C的最外层电子数相等;B、D属于同主族;C、D两元素原子的质子数之和为A、B两元素原子的质子数之和的3倍.请回答下列问题:
(1)A的元素符号为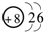
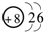 .
.
(2)C2B2中含有的化学键是
(3)A、B、C、D离子半径由大到小的顺序为(用离子符号表示)
(4)用化学方程式证明元素原子的得电子能力B强于D
(1)A的元素符号为
H
H
,B的原子结构示意图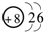
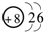
(2)C2B2中含有的化学键是
离子键、共价键
离子键、共价键
,写出C2B2与A2B反应的离子方程式2Na2O2+2H2O═4Na++4OH-+O2↑
2Na2O2+2H2O═4Na++4OH-+O2↑
.(3)A、B、C、D离子半径由大到小的顺序为(用离子符号表示)
S2->O2->Na+>H+
S2->O2->Na+>H+
.(4)用化学方程式证明元素原子的得电子能力B强于D
H2S+O2═H2O+S↓
H2S+O2═H2O+S↓
.分析:A、B、C、D为短周期内除稀有气体外的元素,它们的原子序数依次增大,C为金属元素;A和C的最外层电子数相等,位于同主族,则C为Na,A为H;B、D属于同主族,设B的质子数为x,则D的质子数为x+8,C、D两元素原子的质子数之和为A、B两元素原子的质子数之和的3倍,所以11+x+8=(1+x)×3,解得x=8,即B为O,D为S,以此来解答.
解答:解:A、B、C、D为短周期内除稀有气体外的元素,它们的原子序数依次增大,C为金属元素;A和C的最外层电子数相等,位于同主族,则C为Na,A为H;B、D属于同主族,设B的质子数为x,则D的质子数为x+8,C、D两元素原子的质子数之和为A、B两元素原子的质子数之和的3倍,所以11+x+8=(1+x)×3,解得x=8,即B为O,D为S,
(1)A为H,B为O,其原子结构示意图为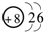 ,故答案为:H;
,故答案为:H;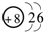 ;
;
(2)C2B2为Na2O2,钠离子与过氧根离子以离子键结合,O、O之间以共价键结合,与水反应的离子反应为2Na2O2+2H2O═4Na++4OH-+O2↑,
故答案为:离子键、共价键;2Na2O2+2H2O═4Na++4OH-+O2↑;
(3)电子层越多,离子半径越大,具有相同电子排布的离子,原子序数大的离子半径小,
则离子半径为S2->O2->Na+>H+,
故答案为:S2->O2->Na+>H+;
(4)利用元素单质的置换反应可说明得电子能力的强弱,如H2S+O2═H2O+S↓,故答案为:H2S+O2═H2O+S↓.
(1)A为H,B为O,其原子结构示意图为
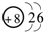 ,故答案为:H;
,故答案为:H;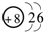 ;
;(2)C2B2为Na2O2,钠离子与过氧根离子以离子键结合,O、O之间以共价键结合,与水反应的离子反应为2Na2O2+2H2O═4Na++4OH-+O2↑,
故答案为:离子键、共价键;2Na2O2+2H2O═4Na++4OH-+O2↑;
(3)电子层越多,离子半径越大,具有相同电子排布的离子,原子序数大的离子半径小,
则离子半径为S2->O2->Na+>H+,
故答案为:S2->O2->Na+>H+;
(4)利用元素单质的置换反应可说明得电子能力的强弱,如H2S+O2═H2O+S↓,故答案为:H2S+O2═H2O+S↓.
点评:本题考查原子结构与元素周期律,元素的推断是解答本题的关键,并熟悉化学用语的使用来解答即可,难度不大.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
【化学一选修3:物质结构与性质】(15分)
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
形
(2)某同学根据上述信息,所画的B电子排布图如图

违背了 原理。
(3)F位于 族 区,其基态原子有 种运动状态。
(4)CD3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其分子空间构型为 .检验E元素的方法是
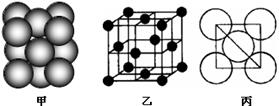
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 .
【化学一选修3:物质结构与性质】(15分)
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
|
A元素原子的核外p电子总数比s电子总数少1 |
|
B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
|
C原子核外所有p轨道全满或半满 |
|
D元素的主族序数与周期数的差为4 |
|
E是前四周期中电负性最小的元素 |
|
F在周期表的第七列 |
(1)A基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈
形
(2)某同学根据上述信息,所画的B电子排布图如图
违背了 原理。
(3)F位于 族 区,其基态原子有 种运动状态。
(4)CD3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其分子空间构型为 .检验E元素的方法是
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 .

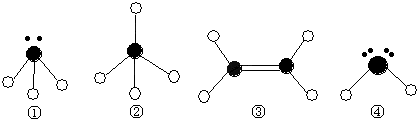

 ,违背了 原理。
,违背了 原理。