题目内容
【题目】下列相关反应的离子方程式书写正确的是
A. Al2O3与过量氨水:Al2O3+2NH3·H2O═2AlO![]() +2NH4++H2O
+2NH4++H2O
B. 钠与水反应:2Na+2H+═2Na++H2↑
C. 铝粉投入到NaOH溶液中:2Al+2OH-=2AlO![]() +H2↑
+H2↑
D. Na2CO3溶液中滴加少量的稀盐酸:H++ CO![]() ═HCO
═HCO![]()
【答案】D
【解析】
A.一水合氨是弱碱,不能溶解氧化铝,该反应不能发生,故A错误;
B.钠是活泼金属,与水反应生成NaOH和氢气,NaOH完全电离,反应的离子方程式为2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.往NaOH溶液中投入铝粉,反应的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑,故C错误;
D.Na2CO3溶液中滴加少量的稀盐酸,离子方程式:H++CO32-═HCO3-,故D正确。
故选D。

【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_________________________________。
(2)该反应的正反应为____________反应(填“吸热”、“放热”)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______________℃。此温度下加入1molCO2(g)和1molH2(g),充分反应,达到平衡时,CO2的转化率为__________。
(4)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol/L ,c(H2)为1.5mol/L,c(CO)为1mol/L, c(H2O)为3mol/L,则正、逆反应速率的比较为υ正________υ逆 。(填“>”、“<”或“=”)
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Cu2+、Ba2+、C1—、SO42—、CO32-。将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验:
实验序号 | 实验内容 | 实验结果 |
a | 加AgNO3溶液 | 有白色沉淀生成 |
b | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
c | 加足量BaC12溶液,将所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数为2.33g |
试回答下列问题:
(1)该混合物中一定不存在的离子是______________________。
(2)试写出实验b发生反应的离子方程式_______________________。
(3)溶液中一定存在的阴离子及其物质的量浓度(可不填满):
阴离子符号 | 物质的量浓度(mol·L—1) |
___________ | ___________ |
___________ | ___________ |
(4)判断混合物中是否存在K+,如果不存在,请说明理由,如果存在,请求出C(K+)的取值范围?______________。
【题目】(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。那么用太阳能分解10mol水消耗的能量是____________kJ;
(2)由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(i)CO(g) + 2H2(g) = CH3OH(g) △H1 = -90.1kJmol-1
(ii)CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H2 = -49.0kJmol-1
水煤气变换反应:
(iii)CO(g) + H2O(g) = CO2(g) + H2 (g) △H3 = -41.1kJmol-1
二甲醚合成反应:
(iV)2 CH3OH(g) = CH3OCH3(g) + H2O(g) △H4 = -24.5kJmol-1
则由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为____________。
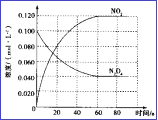
(3)在容积为1.00L的容器中,通入一定量N2O4,发生N2O4(g) ![]() 2NO2(g), 100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,v(N2O4)=_______________________,
2NO2(g), 100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,v(N2O4)=_______________________,
(4)已知反应2HI(g)=H2(g) + I2(g)的ΔH= +11kJ·mol-1,1molH2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___________kJ。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数, 若k正 = 0.0027min-1,在t=40min时,v正=_______min-1



