题目内容
在2SO2+O2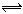 2SO3的反应里,开始SO2和O2的浓度均为0.5mol/L,2分钟后测得SO2的浓度为0.25mol/L,则
2SO3的反应里,开始SO2和O2的浓度均为0.5mol/L,2分钟后测得SO2的浓度为0.25mol/L,则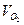 =_____________________,各物质所表示的反应速率的最简整数比
=_____________________,各物质所表示的反应速率的最简整数比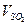 :
: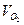 :
: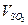 =_________
=_________
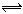 2SO3的反应里,开始SO2和O2的浓度均为0.5mol/L,2分钟后测得SO2的浓度为0.25mol/L,则
2SO3的反应里,开始SO2和O2的浓度均为0.5mol/L,2分钟后测得SO2的浓度为0.25mol/L,则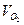 =_____________________,各物质所表示的反应速率的最简整数比
=_____________________,各物质所表示的反应速率的最简整数比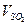 :
: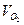 :
: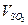 =_________
=_________0.0625mol/( L· min) 2:1:2
略

练习册系列答案
相关题目
 2SO3(g),半分钟后,体系中O2的物质的量变为1.4mol,则此反应的平均速率为
2SO3(g),半分钟后,体系中O2的物质的量变为1.4mol,则此反应的平均速率为 4C(g)+6D(g)在5L的密闭容器中进行反应,30 min后,C的物质的量增加了0.30 mol。下列叙述正确的是
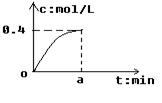
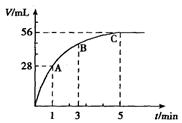
4C(g)+6D(g)在5L的密闭容器中进行反应,30 min后,C的物质的量增加了0.30 mol。下列叙述正确的是 2SO3经a min后,SO3浓度的变化情况如上图所示,在时间0--a min内用O2表示的平均反应速率为0.04mol/(L ·min),则a等于
2SO3经a min后,SO3浓度的变化情况如上图所示,在时间0--a min内用O2表示的平均反应速率为0.04mol/(L ·min),则a等于