��Ŀ����
����Ŀ���ϳɰ���ҵ���ִ�ũҵ��������ҵ�У�������Ҫ�ĵ�λ����֪��N2��g��+3H2��g��![]() 2NH3��g����H=��92kJ��mol��1��
2NH3��g����H=��92kJ��mol��1��
��1�������йظ÷�Ӧ���ʵ���������ȷ���� ��
a�������¶ȿ����������Ӱٷ������ӿ췴Ӧ����
b������ѹǿ�����������Ӱٷ����������Լӿ췴Ӧ����
c��ʹ�ô�������ʹ��Ӧ�����ƽ���������ߣ��ӿ췴Ӧ����
d��������һ��������£����������ı������С���Է�Ӧ����������Ӱ��
��2���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK=_________________��
��3��ij�¶��£�����10 mol N2��30 mol H2 �������Ϊ10 L���ܱ������ڣ���Ӧ�ﵽƽ��״̬ʱ����û�������а����������Ϊ20%������¶��·�Ӧ��K= ���÷�����ʾ����
��4�����ںϳɰ���Ӧ���ԣ������й�ͼ��һ����ȷ����_____________��
a.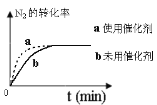 b��
b��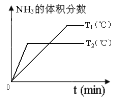 c.
c.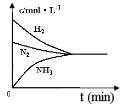
���𰸡���1��abd
��2��![]() ��
��![]()
��3��![]() Lmol-1 ��4��ab
Lmol-1 ��4��ab
��������
�����������1��a�������¶ȣ�����ʹ��ͨ���ӻ��������Ϊ����ӣ�a��ȷ��b������ѹǿ������ʹ��ͨ���ӻ����������˻���Ӱٷ������䣬����������λ����ڻ��������b��ȷ��c������ֻ�ܽ��ͷ�Ӧ�Ļ�ܣ����ܸı䷴Ӧ������������������c����d��������һ��������£����������ı����ԽС����Ӧ����Խ�죬d��ȷ����ѡabd����2��N2��g�� + 3 H2��g�� ![]() 2 NH3��g����ƽ�ⳣ��K =
2 NH3��g����ƽ�ⳣ��K = ![]() ��
��![]() ����3���赪���ı仯Ũ��Ϊxmol/L���������֪��N2��g����H2��g����NH3��g����ƽ��Ũ�ȷֱ���1��x��mol/L����3��3x��mol/L��2xmol/L����ƽ���ǰ������������ =
����3���赪���ı仯Ũ��Ϊxmol/L���������֪��N2��g����H2��g����NH3��g����ƽ��Ũ�ȷֱ���1��x��mol/L����3��3x��mol/L��2xmol/L����ƽ���ǰ������������ = ![]() = 20%����ã�x=1/3����N2��g����H2��g����NH3��g����ƽ��Ũ�ȷֱ�2/3mol/L��2mol/L��2/3mol/L��ƽ�ⳣ��K =
= 20%����ã�x=1/3����N2��g����H2��g����NH3��g����ƽ��Ũ�ȷֱ�2/3mol/L��2mol/L��2/3mol/L��ƽ�ⳣ��K = ![]() =
=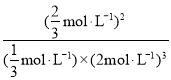 =
= ![]() Lmol-1����4��a��ʹ�ô������ܼӿ췴Ӧ���ʣ�������ʹƽ���ƶ���������ȹ���ƽ����������ƽ��ת���ʱ��ֲ��䣬a��ȷ��b�����ȹ���ƽ�����֪��ͼ��T2 > T1�������ܼӿ췴Ӧ���ʣ���ƽ�������ȷ�����淴Ӧ�����ƶ������������������С����ͼ��һ�£�b��ȷ��c���ӷ�Ӧ��ʼ���ﵽƽ�⣬��ӦN2��g�� + 3 H2��g��
Lmol-1����4��a��ʹ�ô������ܼӿ췴Ӧ���ʣ�������ʹƽ���ƶ���������ȹ���ƽ����������ƽ��ת���ʱ��ֲ��䣬a��ȷ��b�����ȹ���ƽ�����֪��ͼ��T2 > T1�������ܼӿ췴Ӧ���ʣ���ƽ�������ȷ�����淴Ӧ�����ƶ������������������С����ͼ��һ�£�b��ȷ��c���ӷ�Ӧ��ʼ���ﵽƽ�⣬��ӦN2��g�� + 3 H2��g�� ![]() 2 NH3��g�����������ʵı仯Ũ��֮�ȵ���ϵ��֮�Ȼ�1��3��2����ͼ��H2��NH3�ı仯Ũ�ȼ�����ȣ�c����ѡab��
2 NH3��g�����������ʵı仯Ũ��֮�ȵ���ϵ��֮�Ȼ�1��3��2����ͼ��H2��NH3�ı仯Ũ�ȼ�����ȣ�c����ѡab��

 һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�