题目内容
6.(1)常温下,0.2mol•L-1HCl溶液与0.2mol•L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,则①混合溶液中由水电离出的c(H+)>(填“>”、“<”或“=”)原HCl溶液中由水电离出的c(H+).
②求出混合溶液中下列算式的精确计算结果(填具体数字).c(Cl-)-c(M+)=9.9×10-7mol•L-1;
(2)常温下,若将0.2mol•L-1MOH溶液与0.1mol•L-1HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下,MOH的电离程度小于(填“大于”、“小于”或“等于”) MCl的水解程度.
(3)常温下,若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH<7(填“>7”或“<7”或“无法确定”).
(4)AgNO3的水溶液呈酸(填“酸”、“中”或“碱”)性,原因是(用离子方程式表示)Ag++H2O?AgOH+H+;实验室在配制AgNO3溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后用蒸馏水稀释到所需的浓度,以抑制(填“促进”或“抑制”)其水解.
(5)把FeCl3溶液蒸干、灼烧,最后得到的固体产物主要是Fe2O3.
分析 (1)常温下,0.2mol•L-1HCl溶液与0.2mol•L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,说明MCl是强酸弱碱盐,则MOH是弱碱,
①酸或碱抑制水电离,含有弱离子的盐促进水电离;
②任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Cl-)+c(OH-)=c(M+)+c(H+),则c(Cl-)-c(M+)=c(H+)-c(OH-);
(2)常温下,若将0.2mol•L-1MOH溶液与0.1mol•L-1HCl溶液等体积混合,混合溶液中溶质为等物质的量浓度的MOH和MCl,测得混合溶液的pH<7,则说明在相同条件下,MOH的电离程度小于MCl的水解程度;
(3)常温下,若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则HR是弱酸,二者等体积混合时,酸有剩余,溶液呈酸性;
(4)硝酸银是强酸弱碱盐,银离子水解导致溶液呈酸性;酸能抑制硝酸银水解;
(5)氯化铁是强酸弱碱盐,铁离子水解生成氢氧化铁和稀盐酸,盐酸具有挥发性,升高温度促进挥发,蒸干溶液时得到氢氧化铁固体,灼烧氢氧化铁时氢氧化铁分解.
解答 解:(1)常温下,0.2mol•L-1HCl溶液与0.2mol•L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,说明MCl是强酸弱碱盐,则MOH是弱碱,
①酸或碱抑制水电离,含有弱离子的盐促进水电离,所以盐酸抑制水电离,MCl溶液促进水电离,则混合溶液中由水电离出的c(H+)>原HCl溶液中由水电离出的c(H+),
故答案为:>;
②任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Cl-)+c(OH-)=c(M+)+c(H+),则c(Cl-)-c(M+)=c(H+)-c(OH-)=10-6mol/L-10-8 mol/L=9.9×10-7 mol/L,故答案为:9.9×10-7;
(2)常温下,若将0.2mol•L-1MOH溶液与0.1mol•L-1HCl溶液等体积混合,混合溶液中溶质为等物质的量浓度的MOH和MCl,测得混合溶液的pH<7,则说明在相同条件下,MOH的电离程度小于MCl的水解程度,故答案为:小于;
(3)常温下,若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则HR是弱酸,二者等体积混合时,酸有剩余,溶液呈酸性,则溶液的pH<7,故答案为:<7;
(4)硝酸银是强酸弱碱盐,银离子水解导致溶液呈酸性,水解方程式为Ag++H2O?AgOH+H+;硝酸中含有氢离子,所以硝酸能抑制硝酸银水解,
故答案为:酸;Ag++H2O?AgOH+H+;抑制;
(5)氯化铁是强酸弱碱盐,铁离子水解生成氢氧化铁和稀盐酸,盐酸具有挥发性,升高温度促进挥发,蒸干溶液时得到氢氧化铁固体,灼烧氢氧化铁时氢氧化铁分解生成氧化铁和水,则最终得到的固体是Fe2O3,故答案为:Fe2O3.
点评 本题考查酸碱混合溶液定性判断及盐类水解,为高频考点,正确判断电解质强弱及混合溶液成分及其性质是解本题关键,注意蒸干灼烧硫酸铁和氯化铁溶液区别,题目难度不大.

 全能测控一本好卷系列答案
全能测控一本好卷系列答案| A. | 越活泼的金属越难冶炼 | |
| B. | 合金的性质与其成分金属的性质不完全相同 | |
| C. | 金属冶炼的本质是金属阳离子得到电子变成金属原子 | |
| D. | 工业上金属Mg、Al都是用电解其熔融的氯化物制得的 |
| A. | 该溶液的物质的量浓度为1mol•L-1 | |
| B. | 该溶液中含有29.25gNaCl | |
| C. | 配制100 mL该溶液需称量5.85gNaCl | |
| D. | 量取100 mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1mol |
| A. | K+、H+、SO42-、OH- | B. | Na+、H+、Cl-、CO32- | ||
| C. | Na+、Ca2+、CO32-、NO3- | D. | K+、Cu2+、Cl-、SO42- |
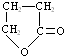 ,化合物C的结构简式是HOCH2CH=CHCOONa.
,化合物C的结构简式是HOCH2CH=CHCOONa.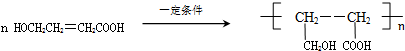 .
.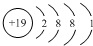 ,E元素的电子排布式为1s22s22p63s23p63d5s4s1.
,E元素的电子排布式为1s22s22p63s23p63d5s4s1.