题目内容
【题目】某兴趣小组用0.50 mol/L KI、0.2%淀粉溶液、0.20 mol/L K2S2O8、0.10 mol/L Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I-=2SO42-+I2(慢)
I2+2S2O32-=2I-+S4O62-(快)
(1)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:
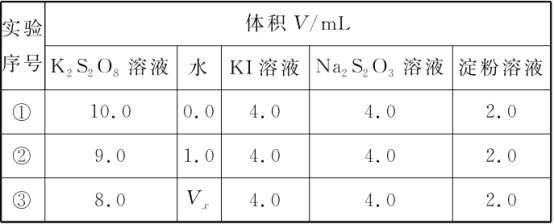
表中Vx=________mL,理由是__________。
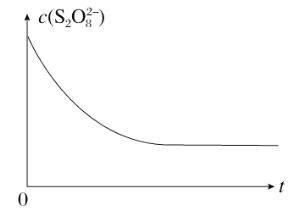
(2)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如下图,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)~t的变化曲线示意图(进行相应的标注)。_______
【答案】V=2.0 仅使反应物S2O82-的浓度改变而其他物质浓度不变,才能得出合理的实验结论。 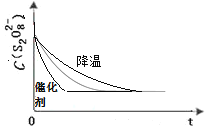
【解析】
(1)由于要保证反应物K2S2O8浓度改变,而其他的不变,才到达实验目的;
(2)降低温度反应速率降低,则需要的反应时间增加。催化剂能加快反应速率,需要的反应时间减少。
(1)由于要保证反应物K2S2O8浓度改变,而其他的不变,才到达实验目的,所以根据实验中的数据可知,溶液的总体积是20mL,因此Vx=20mL-8.0mL-4.0mL-4.0mL-2.0mL=2.0mL;
(2)降低反应温度,反应速率减慢,此时曲线应画在已知曲线的右边;加入催化剂,反应速率明显增大,此时曲线应画在已知曲线的左边,所以正确的图像是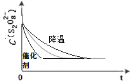 。
。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。

发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由_____。
(2)加入沸石的作用是_____。若加热后发现未加沸石,应采取的正确方法是______。
(3)上述装置图中,B仪器的名称是_____,D仪器的名称是_____。
(4)分液漏斗使用前必须进行的操作是_____(填正确答案标号)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在_____层(填“上”或“下”)
(6)反应温度应保持在90—95℃,其原因是_____。
(7)本实验中,正丁醛的产率为_____%。