题目内容
12.除去如表各组物质中的少量杂质,所用方法正确的是( )| 选项 | 物质 | 杂质 | 除杂方法 |
| A | Cu | CuO | 在空气中灼烧 |
| B | CaO | Ca(OH)2 | 加入足量的稀盐酸 |
| C | H2 | CO | 通入O2,点燃 |
| D | O2 | H2O | 通过浓硫酸洗气 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、在空气中灼烧时,能将Cu转化为CuO;
B、盐酸和氧化钙和氢氧化钙均反应;
C、氢气和CO均为可燃性气体;
D、氧气是中性气体,和浓硫酸不反应.
解答 解:A、在空气中灼烧时,能将Cu转化为CuO,故不但不能除去CuO,还将主要物质反应也反应了,故A错误;
B、盐酸和氧化钙和氢氧化钙均反应,故加入足量的盐酸后,将两者均完全反应,故B错误;
C、氢气和CO均为可燃性气体,故通入氧气并点燃后,氢气和CO均燃烧,故C错误;
D、氧气是中性气体,和浓硫酸不反应,故能用浓硫酸除去氧气中的水,故D正确.
故选D.
点评 本题考查了常见的物质的除杂问题,应把握住除杂的原则是:不引入新杂质,不伤害到主体物质.

练习册系列答案
相关题目
2.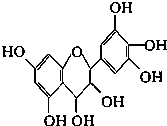 从葡萄籽中提取的原花青素结构为:原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病.有关原花青素的下列说法不正确的是( )
从葡萄籽中提取的原花青素结构为:原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病.有关原花青素的下列说法不正确的是( )
 从葡萄籽中提取的原花青素结构为:原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病.有关原花青素的下列说法不正确的是( )
从葡萄籽中提取的原花青素结构为:原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病.有关原花青素的下列说法不正确的是( )| A. | 该物质既可看作醇类,也可看作酚类 | |
| B. | 1mol该物质可与4molBr2反应 | |
| C. | 1mol该物质可与7molNaOH反应 | |
| D. | 1mol该物质可与7molNa反应 |
3.X、Y、Z、W、M是五种短周期主族元素,它们的核电荷数依次增大.其中X和W同主族,W原子的电子数等于Y和Z的最外层电子数之和,Z2-和M3+具有相同的电子层结构.下列说法正确的是( )
| A. | X、Y、Z形成的化合物中不可能既有离子键 | |
| B. | X和Z、M和Y、Z和W均可形成原子个数比为1:1的化合物 | |
| C. | Y、Z、W、M形成的简单离子半径大小关系为Y>Z>M>W | |
| D. | W与Cl形成化合物的熔点低于M与Cl形成化合物的熔点 |
7.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 水电离的c( H+)=1×l0-13 mol/L的溶液中:K+、Na+、SiO32-、SO42- | |
| B. | 能使石蕊呈蓝色的溶液中:Na+、Fe3+、SO42-、Cl- | |
| C. | $\frac{{K}_{W}}{c(O{H}^{-})}$=l×l0-13mol/L的溶液中:Ba2+、ClO-、Cl-、NO3- | |
| D. | 能与铝反应放出H2的溶液中:Fe2+、K+、SO42-、Cl- |
17.常温下pH=4的FeCl3溶液和pH=10的K2CO3溶液中,水的电离程度( )
| A. | FeCl3溶液大 | B. | K2CO3溶液大 | C. | 一样大 | D. | 无法确定 |
4.下列离子方程式正确的是( )
| A. | 向氨水中滴入盐酸:OH-+H+=H2O | |
| B. | Cl2与冷NaOH溶液反应:Cl2+2OH-=Cl-+ClO-+H2O | |
| C. | 盐酸与AgNO3反应:Ag++HCl=AgCl↓+H+ | |
| D. | 氢氧化钡溶液与稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
1.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 含有NA个氮原子的氮气的体积约为11.2L | |
| B. | 标准状况下,11.2L H2O含有的分子数为0.5NA | |
| C. | 常温常压下,11.2L Cl2含有的分子数为0.5NA | |
| D. | 常温常压下,64g SO2中含有的原子数为3NA |
2.设阿伏加德罗常数的值为NA,则下列说法正确的是( )
| A. | 常温常压下,18.0g NH4+中所含的质子数为10NA | |
| B. | 室温下,8g甲烷含有共价键数为2NA | |
| C. | 常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA | |
| D. | 111g CaCl2晶体中所含共用电子对的数目为2NA |