题目内容
将固体FeC2O4·2H2O放在一个可称量的容器中加热灼烧,固体质量随温度升高而变化,测得数据如下:温度/℃ | 25 | 300 | 350 | 400 | 500 | 600 | 900 |
固体质量/g | 1.000 | 0.800 | 0.800 | 0.400 | 0.444 | 0.444 | 0.429 |
根据以上数据进行计算和分析,完成下列填空:
(1)写出25~300 ℃时固体发生变化的化学方程式 ,判断理由是 。
(2)350~400 ℃时固体发生变化得到的产物是 ,物质的量之比为 。
(3)500 ℃时产物的含氧质量分数为 。
(4)写出600~900 ℃时固体发生变化的化学方程式 。
解析:(1)通过计算可知固体减少的质量刚好等于
(2)在350~400 ℃,FeC2O4进一步分解,质量减少一半,比较FeC2O4与铁的氧化物的相对分子质量,只有剩余固体为FeO符合要求,由反应式:
![]()
得生成物的物质的量之比为1∶1∶1。
(3)(4)问是有紧密联系的,在400~500 ℃,FeO在灼烧过程中质量增加,可能是结合空气中的氧生成高价的氧化物,600~900 ℃过程中固体质量又减小,由此推测固体物质可能发生如下变化:6FeO→3Fe2O3(结合氧原子)→2Fe3O4(再失去氧原子),用表中的数据进行验证:
2FeO~Fe2O3 Δm(增加)
144 16
0.400 0.444-0.400=0.044
3Fe2O3~2Fe3O4 Δm(减少)
480 16
0.444 0.444-0.429=0.015
由上可知符合要求,因此500 ℃时产物为Fe2O3,含氧的质量分数为30%,600~900 ℃时的反应式为:
![]()
由以上分析可知FeC2O4·2H2O在加热灼烧过程中经过一个复杂的变化过程,即由FeC2O4·2H2O→FeC2O4→FeO→Fe2O3→Fe3O4。将上述的过程绘制成如下图所示,更能方便地看清整个变化过程。
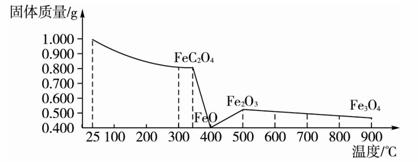
FeC2O4·2H2O受热分解的质量变化
答案:(1) ![]() 固体减少的质量刚好等于FeC2O4·2H2O中所含的结晶水的质量
固体减少的质量刚好等于FeC2O4·2H2O中所含的结晶水的质量
(2)FeO、CO、CO2 1∶1∶1
(3)30%
(4) ![]()

温度/℃ | 25 | 300 | 350 | 400 | 500 | 600 | 900 |
固体质量/g | 1.000 | 0.800 | 0.800 | 0.400 | 0.444 | 0.444 | 0.430 |
根据计算分析推理,完成下列填空:?
(1)写出25~300 ℃时固体发生变化的化学反应方程式? ? ,判断的理由是 。?
(2)350~400 ℃发生变化得到的产物是 ,物质的量之比为 。?
(3)500 ℃时产物的含氧质量分数为 。?
(4)写出600~900 ℃时发生变化的化学方程式 。
将固体FeC2O4·2H2O放在一个可称量的容器中加热灼烧,固体质量随温度升高而变化,测得数据如下:
| 温度/℃ | 25 | 300 | 350 | 400 | 500 | 600 | 900 |
| 固体质量/g | 1.000 | 0.800 | 0.800 | 0.400 | 0.444 | 0.444 | 0.429 |
根据以上数据进行计算和分析,完成下列填空:
(1)写出25~300 ℃时固体发生变化的化学方程式 ,判断理由是 。
(2)350~400 ℃时固体发生变化得到的产物是 ,物质的量之比为 。
(3)500 ℃时产物的含氧质量分数为 。
(4)写出600~900 ℃时固体发生变化的化学方程式 。
将固体FeC2O4?2H2O放在一个可称量的容器中加热灼烧,固体质量随温度升高而变化,测得数据如下:
| 温度/℃ | 25 | 300 | 350 | 400 | 500 | 600 | 900 |
| 固体质量/g | 1.000 | 0.800 | 0.800 | 0.400 | 0.444 | 0.444 | 0.430 |
根据计算分析推理,完成下列填空:
(1)写出25~300℃时固体发生变化的反应方程式 判断的理由是 。
(2)350~400℃发生变化得到的产物是 ,物质的量之比为 。
(3)500℃时产物的含氧质量分数为 。
(4)写出600~900℃时发生变化的化学方程式 。
[s1] 将固体FeC2O4·2H2O放在一个可称量的容器中加热灼烧,固体质量随温度升高而变化,测得数据如下:
|
温度/℃ |
25 |
300 |
350 |
400 |
500 |
600 |
900 |
|
固体质量/g |
1.000 |
0.800 |
0.800 |
0.400 |
0.444 |
0.444 |
0.430 |
根据计算分析推理,完成下列填空:
(1)写出25~300℃时固体发生变化的反应方程式 判断的理由是 。
(2)350~400℃发生变化得到的产物是 ,物质的量之比为 。
(3)500℃时产物的含氧质量分数为 。
(4)写出600~900℃时发生变化的化学方程式 。
[s1]30.