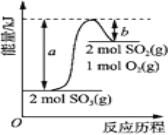
题目内容
【题目】易混易错题组
物质在水中可能存在电离平衡、盐类的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学的知识回答:
(1)A为0.1 molL-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为________________________________________________。
(2)B为0.1 molL-1 NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(共3个,分别用离子方程式表示):_____________________________________________
(3)C为Al2(SO4)3溶液,实验室中配制Al2(SO4)3溶液时通常需要向其中加入_______________,若把B和C溶液混合,将产生白色沉淀和无色气体,该反应的离子方程式为___________________。
(4)pH=2的某酸HnA(An-为酸根)与pH=12的某碱B(OH)m混合,恰好反应生成正盐,混合液pH=8,反应生成的正盐的化学式为_________,盐中________离子一定能水解,其第一步水解的离子方程式为_______________________。
【答案】 c(NH)>c(SO![]() )>c(H+)>c(OH-) HCO3-
)>c(H+)>c(OH-) HCO3-![]() H++CO32-、HCO3-+H2O
H++CO32-、HCO3-+H2O![]() H2CO3+OH-、H2O
H2CO3+OH-、H2O![]() H++OH- 硫酸 Al3++3HCO===Al (OH)3↓+3CO2↑ BnAm An-
H++OH- 硫酸 Al3++3HCO===Al (OH)3↓+3CO2↑ BnAm An- ![]()
![]()
【解析】试题分析:(1)硫酸铵是强酸弱碱盐,铵根离子水解而使溶液呈酸性,再结合电荷守恒判断离子浓度大小顺序;(2)碳酸氢钠溶液中存在水的电离平衡、碳酸氢根离子离子的电离平衡和水解平衡;(3)Al2(SO4)3易水解呈酸性,为防止其水解配制时要加入少量酸;碳酸氢钠和Al2(SO4)3发生双水解而生成氢氧化铝沉淀和二氧化碳气体;(4)根据化合价代数和等于0写正盐的化学式;混合液pH=8,说明为强碱弱酸盐,酸根离子水解;
解析:(1)硫酸铵是强酸弱碱盐,铵根离子水解而使溶液呈酸性,即c(H+)>c(OH-),溶液中存在电荷守恒c(NH4+)+c(H+)=2c(SO42-)+c(OH-),则c(NH4+)>c(SO42-),铵根离子水解较微弱,所以c(SO42-)>c(H+),则该溶液中离子浓度大小顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-);(2)碳酸氢钠溶液中存在碳酸氢根离子离子的电离平衡和水解平衡、水的电离平衡,离子方程式分别为:HCO3-H++CO32-、HCO3-+H2OH2CO3+OH-、H2OH++OH-;(3)Al2(SO4)3是强酸弱碱盐,铝离子水解而使其溶液呈酸性,为防止氯化铝水解,所以在配制Al2(SO4)3溶液时向溶液中加入少量的硫酸,Al2(SO4)3和碳酸氢钠发生双水解反应而生成氢氧化铝沉淀,同时生成二氧化碳气体,离子反应方程式为Al3++3HCO===Al(OH)3↓+3CO2↑;
(4)根据化合价代数和等于0,该正盐的化学式为BnAm;混合液pH=8,说明为强碱弱酸盐,酸根离子水解,所以An-离子一定水解,第一步水解的离子方程式为![]()
![]() ;
;

【题目】从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A.使用催化剂 B.适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
(2)下图能正确表示该反应中能量变化的是________。
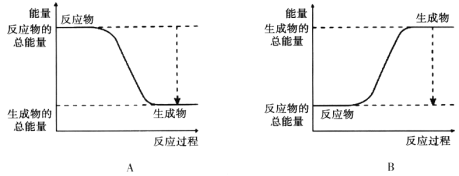
(3)从断键和成键的角度分析上述反应中能量的变化。
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
请填写下表:
化学键 | 填“吸收热量”或“放出热量” | 能量变化(kJ) | |
拆开化学键 | 2molH2化学键 | ________ | ________ |
1molO2化学键 | |||
形成化学键 | 4molH-O键 | ________ | ________ |
总能量变化 | ________ | ________ | |
(4)氢氧燃料电池的总反应方程式为2H2 +O2=2H2O。其中,氢气在______极发生_______反应。电路中每转移0.2mol电子,标准状况下消耗H2的体积是______L。