题目内容
【题目】某温度下,pH相同的盐酸和醋酸溶液加水稀释后随溶液体积变化的曲线如右图所示。据图判断正确的是( )
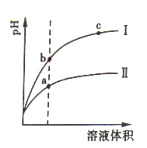
A.Ⅱ为盐酸稀释时pH值变化曲线 B.a点Kw的数值比c点Kw的数值大
C.b点溶液的导电性比c点溶液的导电性强 D.b点酸的总浓度大于a点酸的总浓度
【答案】C
【解析】
试题分析:A、稀释前pH相同,则c(H+)盐酸=c(H+)醋酸,n(H+)盐酸=n(H+)醋酸,由于HCl是强酸、CH3COOH是弱酸,弱酸存在电离平衡:CH3COOH![]() CH3COO—+H+,且稀释能促进醋酸分子电离出H+,则稀释后,n`(H+)盐酸 < n`(H+)醋酸,c`(H+)盐酸 < c`(H+)醋酸,则pH(盐酸)稀释后 > pH(醋酸)稀释后,即I为盐酸稀释时pH值变化曲线、II为醋酸稀释时pH值变化曲线,A错误;B、Kw只与温度有关,与稀释无关,相同温度下,a点Kw的数值比c点Kw的数值一定相等,B错误;C、溶液的导电性与离子浓度及其所带电荷均成正比,pH(b点) > pH(c点),说明c(H+)c点<c(H+)b点,由于c(Cl-) c点=c(H+)c点,c(Cl-) b点=c(H+)b点,则c(Cl-) c点< c(Cl-) b点,则b点溶液中阴阳离子浓度均大于c点,C正确;D、相同pH的盐酸和醋酸,醋酸浓度远大于盐酸的浓度,由稀释定律(c浓V浓 = c稀V稀)可知,稀释到相同体积时,醋酸(II)浓度仍大于盐酸(I)浓度,D错误;答案选C。
CH3COO—+H+,且稀释能促进醋酸分子电离出H+,则稀释后,n`(H+)盐酸 < n`(H+)醋酸,c`(H+)盐酸 < c`(H+)醋酸,则pH(盐酸)稀释后 > pH(醋酸)稀释后,即I为盐酸稀释时pH值变化曲线、II为醋酸稀释时pH值变化曲线,A错误;B、Kw只与温度有关,与稀释无关,相同温度下,a点Kw的数值比c点Kw的数值一定相等,B错误;C、溶液的导电性与离子浓度及其所带电荷均成正比,pH(b点) > pH(c点),说明c(H+)c点<c(H+)b点,由于c(Cl-) c点=c(H+)c点,c(Cl-) b点=c(H+)b点,则c(Cl-) c点< c(Cl-) b点,则b点溶液中阴阳离子浓度均大于c点,C正确;D、相同pH的盐酸和醋酸,醋酸浓度远大于盐酸的浓度,由稀释定律(c浓V浓 = c稀V稀)可知,稀释到相同体积时,醋酸(II)浓度仍大于盐酸(I)浓度,D错误;答案选C。

练习册系列答案
相关题目
