题目内容
已知某反应的△H=-150kJ?mol-1,下列有关该反应的叙述正确的是( )
分析:根据在可逆反应过程中活化能有正反应和逆反应两种,焓变与活化能的关系是△H=正反应的活化能-逆反应的活化能;△H<0,则反应物的总能量大于生成物的总能量.
解答:解:A、该反应为放热反应,所以反应物总能量大于生成物总能量,故A错误;
B、某反应的△H=-150kJ?mol-1,则正反应的活化能-逆反应的活化能=-150kJ?mol-1,无法确定逆反应活化能的大小,故B错误;
C、某反应的△H=-150kJ?mol-1,则正反应的活化能-逆反应的活化能=-150kJ?mol-1,无法确定正反应活化能的大小,故C错误;
D、某反应的△H=-150kJ?mol-1,则正反应的活化能-逆反应的活化能=-150kJ?mol-1,即逆反应活化能比正反应活化能大150 kJ?mol-1,故D正确;
故选:D.
B、某反应的△H=-150kJ?mol-1,则正反应的活化能-逆反应的活化能=-150kJ?mol-1,无法确定逆反应活化能的大小,故B错误;
C、某反应的△H=-150kJ?mol-1,则正反应的活化能-逆反应的活化能=-150kJ?mol-1,无法确定正反应活化能的大小,故C错误;
D、某反应的△H=-150kJ?mol-1,则正反应的活化能-逆反应的活化能=-150kJ?mol-1,即逆反应活化能比正反应活化能大150 kJ?mol-1,故D正确;
故选:D.
点评:本题主要考查了焓变与活化能的关系,需要注意的是活化能有正反应和逆反应两种.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2C(g)
2C(g)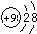
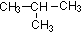
 2C(g)
2C(g)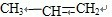 +Br2→
+Br2→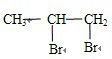
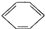 +HO-NO2
+HO-NO2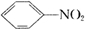 +H2O
+H2O