题目内容
【题目】铁、钴(Co)、镍(Ni)是同族元素,它们的化合物在工业上有重要的应用。
(1)现将含0.5mol FeCl3的溶液和含0.5mol KSCN的溶液混合,混合后溶液体积为1L,已知溶液存在平衡:Fe3+(aq)+SCN-(aq) ![]() Fe(SCN)2+(aq)(忽略其它过程)。
Fe(SCN)2+(aq)(忽略其它过程)。
平衡浓度c[Fe(SCN)2+]与温度T的关系如图所示:
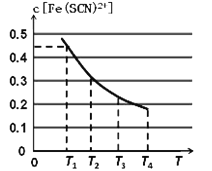
则该反应△H____0(填“>”或“<”),温度为T1时,反应在5秒钟时达到平衡,平c[Fe(SCN)2+]=0.45 mol/L,求达到平衡时的平均反应速率v(SCN-)=____mol·L-1·S-1,该温度下的Fe3+的平衡转化率为_____,该温度下反应的平衡常数为__________。
(2)草酸钴(CoC2O4)是一种难溶于水的浅粉红色粉末,通常用硫酸钴溶液和草酸铵溶液反应制得,写出该反应的离子方程式:______________________。
(3)已知某溶液中,Co2+、Ni2+的浓度分别为0.60mol/L和1.2mol/L,取一定量的该溶液,向其中滴加NaOH溶液,已知Ksp[Co(OH)2]=6.0×10﹣15,Ksp[Ni(OH)2]=2.0×10﹣15,当Co(OH)2开始沉淀时,溶液中![]() 的值等于______。(取两位有效数字)
的值等于______。(取两位有效数字)
(4)CoxNi(1-x)Fe2O4 (其中Co、Ni均为+2价)可用作H2O2分解的催化剂,具有较高的活性。两种不同方法制得的催化剂在10℃时催化、分解6%的H2O2溶液的相对初始速率随x变化的曲线如图所示。
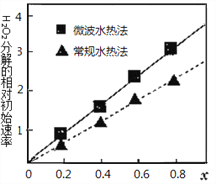
由图中信息可知:__________法制取得到的催化剂活性更高;Co2+、Ni2+ 两种离子中催化效果较好的是_____________________。
【答案】 < 0.09 90% 180 CO2— + Co2+ = CoCO↓ 3.0 微波水热 Co2+
【解析】(1)根据图像可知升高温度c[Fe(SCN)2+]减小,这说明升高温度平衡向逆反应方向进行,所以正反应是放热反应,则该反应△H<0;温度为T1时,反应在5秒钟时达到平衡,平衡时c[Fe(SCN)2+]=0.45 mol/L,则消耗SCN-的浓度是0.45mol/L,因此达到平衡时的平均反应速率v(SCN-)=0.45mol/L÷5s=0.09mol·L-1·S-1,消耗铁离子是0.45mol,所以该温度下的Fe3+的平衡转化率为![]() ×100%=90%。平衡时Fe3+(aq)、SCN-(aq)的浓度分别是0.05mol/L,所以该温度下反应的平衡常数为
×100%=90%。平衡时Fe3+(aq)、SCN-(aq)的浓度分别是0.05mol/L,所以该温度下反应的平衡常数为![]() =180。(2)硫酸钴溶液和草酸铵溶液发生复分解反应生成难溶的草酸钴,反应的离子方程式为CO2— + Co2+ = CoCO↓;(3)当Co2+开始沉淀时,溶液中存在两个溶解平衡:CO(OH)2CO2++2OH-,Ni(OH)2Ni2++2OH-,溶液中c(Co2+)/c(Ni2+)=c2(OH-)c(Co2+)/c2(OH-)c(Ni2+)=Ksp[Co(OH)2]/Ksp[Ni(OH)2]=3.0;(4)过氧化氢的分解速率越大,催化剂活性更高,根据图象可知,x相同时,微波水热法初始速度大于常规水热法,故微波水热法制得催化剂的活性更高;由图可知,随x值越大,过氧化氢的分解速率越大,而x增大,Co2+的比例增大,故Co2+的催化活性更高。
=180。(2)硫酸钴溶液和草酸铵溶液发生复分解反应生成难溶的草酸钴,反应的离子方程式为CO2— + Co2+ = CoCO↓;(3)当Co2+开始沉淀时,溶液中存在两个溶解平衡:CO(OH)2CO2++2OH-,Ni(OH)2Ni2++2OH-,溶液中c(Co2+)/c(Ni2+)=c2(OH-)c(Co2+)/c2(OH-)c(Ni2+)=Ksp[Co(OH)2]/Ksp[Ni(OH)2]=3.0;(4)过氧化氢的分解速率越大,催化剂活性更高,根据图象可知,x相同时,微波水热法初始速度大于常规水热法,故微波水热法制得催化剂的活性更高;由图可知,随x值越大,过氧化氢的分解速率越大,而x增大,Co2+的比例增大,故Co2+的催化活性更高。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案