题目内容
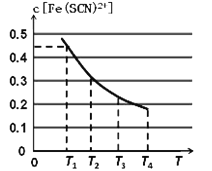
【题目】已知乙酸(HA)的酸性比甲酸(HB)弱,常温下0.1mol/L HA和0.1mol/L HB的pH均大于2。在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序正确的是( )
A. c(OH-)>c(HA)>c(HB)>c(H+) B. c(OH-)>c(A-)>c(B-)>c(H+)
C. c(OH-)>c(B-)>c(A-)>c(H+) D. c(OH-)>c(HB)>c(HA)>c(H+)
【答案】A
【解析】常温下0.1mol/L HA和0.1mol/L HB的pH均大于2,所以两者均为弱酸。在溶液中存在如下3个平衡,A-+H2O![]() HA+OH-、B-+H2O
HA+OH-、B-+H2O![]() HB+OH- 、H2O
HB+OH- 、H2O![]() H++OH-,水电离的氢离子大部分被 A-和B-结合,促进了水的电离使溶液呈碱性,在3个平衡体系中都生成氢氧根。因为HA的酸性比HB弱,所以在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,A-的水解程度比B-的大,所以c(OH-)>c(HA)>c(HB)>c(H+), A正确。
H++OH-,水电离的氢离子大部分被 A-和B-结合,促进了水的电离使溶液呈碱性,在3个平衡体系中都生成氢氧根。因为HA的酸性比HB弱,所以在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,A-的水解程度比B-的大,所以c(OH-)>c(HA)>c(HB)>c(H+), A正确。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目