题目内容
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列反应合成甲醇:CO (g)+2H2(g) CH3OH(g);该反应的平衡常数表达式为 。
CH3OH(g);该反应的平衡常数表达式为 。
(2)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,5min时达到平衡,测得 c(CH3OH)=0.8 mol·L-1 ,则H2的化学反应速率为 ,CO的转化率为___________。
,则H2的化学反应速率为 ,CO的转化率为___________。
(3)下列叙述中,能说明反应已达到化学平衡状态的是_______(填序号字母)。
A. 容器内CO、H2、CH3OH的浓度之比为1∶2∶1
B.v(CO) (正):v(H2) (逆) =1:2
C.容器内压强保持不变
D.混合气体的平 均分子量保持不变
均分子量保持不变
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH1=-1452.8 kJ·mol-
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: .
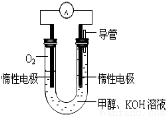
(5)某同学依据甲醇燃烧的反应原理,设计如图所示的电池装置:工作一段时间后,测得溶液的pH将 填“升高”、“降低”、“不变”),该燃料电池负极反应的离子方程式为: 。
练习册系列答案
相关题目


 ol·L-1CH3COOH溶液,加水稀释过程中,所有离子浓度均减小
ol·L-1CH3COOH溶液,加水稀释过程中,所有离子浓度均减小