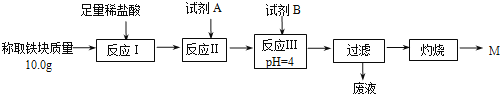
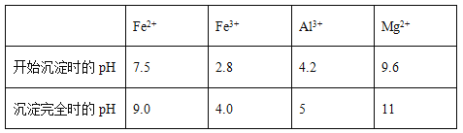
题目内容
【题目】CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(1) CO2经催化加氢可合成低碳烯烃: 2CO2(g)+6H2(g)CH4(g)+4H2O(g),正反应放热。在1L恒容密闭容器内,按n(CO2): n(H2)=1:3投料,测得各组分物质的量随时间变化如下图所示:
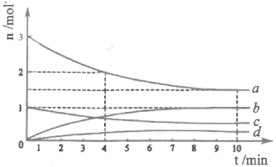
①该反应的△H____(填 “>”,“=”或“<" )0。
②曲线b表示的物质为____ (填化学式),该物质在0~4min内的平均反应速率为______。(保留2位小数)
(2)一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如下图所示
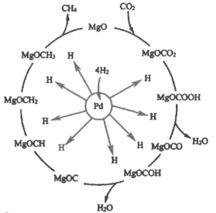
①该反应的化学方程式为_________;
②理论上每有1mol CO2参加反应,反应过程中转移的电子数为_______ mol.
【答案】< H2O 0.17molL-1min-1 CO2+4H2 ![]() CH4+ 2H2O 8
CH4+ 2H2O 8
【解析】
对于2CO2(g)+6H2(g)CH4(g)+4H2O(g)来说,按n(CO2): n(H2)=1:3投料,反应从正向开始进行,CO2和H2的物质的量不断减少,CH4和H2O的物质的量不断增加,直至达到平衡;从反应机理图示可知,反应物为CO2和H2,生成物为CH4和H2O。
(1) ①由题意可知,该反应的正反应为放热反应,故△H<0。
②b的物质的量增加了1mol,d的物质的量增加小于b,根据反应方程式可知,CH4(g)与H2O(g)的生成量比为1:4,故b为H2O。
(2) ①根据图示可知,反应物为CO2和H2,生成物为CH4和H2O,则该反应的化学方程式为CO2+4H2 ![]() CH4+ 2H2O;
CH4+ 2H2O;
②根据反应方程式可知,碳元素化合价由+4价变为-4价,故理论上每有1mol CO2参加反应,反应过程中转移的电子数为8mol。

【题目】下列装置中同时通入a、b两种气体,瓶中实验现象错误的是
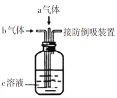
选项 | a气体 | b气体 | c溶液 | 实验现象 |
A | Cl2(1mol) | SO2(1mol) | 品红溶液 | 溶液颜色变浅或褪色 |
B | H2S | SO2 | 水 | 产生淡黄色沉淀 |
C | SO2 | NO2 | BaCl2溶液 | 产生白色沉淀 |
D | NO | O2 | 滴加少量酚酞的NaOH溶液 | 溶液颜色变浅或褪色 |
A.AB.BC.CD.D
【题目】乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料, 可用作止痛剂、退热剂、防腐剂和染料中间体,乙酰苯胺的制备原理为:![]() +CH3COOH
+CH3COOH![]() +H2O,有关物质的性质如下表:
+H2O,有关物质的性质如下表:
名称 | 式量 | 性状 | 密度/g·cm-3 | 沸点/℃ | 溶解度 | |
苯胺 | 93 | 无色油状液体,易氧化 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚 |
乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 | 易溶于乙醇、乙醚 |
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。
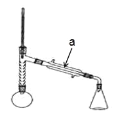
实验步骤:
步骤 1:在圆底烧瓶中加入无水苯胺 9.2 mL,冰醋酸 17.4 mL,锌粉 0.1 g,安装仪器, 加入沸石,调节加热温度,使分馏柱顶温度控制在 105℃ 左右,反应约 60~80 min,反应 生成的水及少量醋酸被蒸出。
步骤 2:在搅拌下,趁热将烧瓶中的物料以细流状倒入盛 100 mL 冰水的烧杯中,剧烈搅拌,并冷却,结晶,抽滤、洗涤、干燥,得到乙酰苯胺粗品。
步 骤 3:将此粗乙酰苯胺进行重结晶,晾干,称重,计算产率。
(1)仪器 a 的名称____________________;
(2)步骤 1 加热可用______________(填“水浴”或“油浴”);
(3)制备过程中加入粒的作用:___________________;
(4)从化学平衡的角度分析,控制分馏柱上端的温度在 105℃左右的原因_______________________;
(5)乙酰苯胺粗品因含杂质而显色,欲用重结晶进行提纯,步骤如下:粗产品溶于沸水中配 成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→趁热过滤→________________→过 滤→洗涤→干燥;
(6)该实验最终得到纯品 10.8g,则乙酰苯胺的产率是______________;
(7)如果重结晶过程中,加入活性炭过多,会造成产率下降,其可能原因为_________________。
【题目】下列对有关事实分析不正确的是
选项 | 事实描述 | 相关知识分析 |
A | 谚语“正月打雷麦谷堆”、“雷雨肥庄稼” | 自然固氮:N2+2O2 |
B | 成语“滴水石穿” | 包含CaCO3+CO2+H2O=Ca(HCO3)2 |
C | 《木草经集注》记载“强烧之,紫青烟起,云是真硝石也。” | “硝石”为KNO3,钾元素的焰色反应为紫色 |
D | 野外之鬼磷,其火色青,其状如炬,或聚或散,俗称鬼火,实乃诸血之磷光也。 | “磷光”是指磷化氢(PH3)自燃,将化学能转化为光能 |
A.AB.BC.CD.D