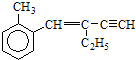题目内容
【题目】实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为: MnO2 + 4HCl(浓)![]() MnCl2+Cl2↑+2H2O。取足量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为11.2L。请计算:
MnCl2+Cl2↑+2H2O。取足量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为11.2L。请计算:
(1)参加反应的二氧化锰的质量为多少克?____________
(2)反应中被氧化的HCl的物质的量为多少摩尔?____________
【答案】 43.5g 1mol
【解析】已知氯气在标准状况下的体积为11.2L,n(Cl2)= 11.2L/22.4mol/L=0.5mol;
(1)MnO2 + 4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
87g 1mol
m(MnO2) 0.5mol
m(MnO2)== 43.5g
(2)氯气由氯化氢氧化而得,故每生成0.5mol氯气需要有1molHCl被氧化。

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目