题目内容
【题目】2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=﹣99kJmol﹣1 . 请回答下列问题: 图中A表示 , E的大小对该反应的反应热(填“有”或“无”)影响.该反应通常用V2O5作催化剂,加V2O5会使图中B点(填“升高”还是“降低”),△H(填“变大”、“变小”或“不变”).图中△H=kJmol﹣1 . 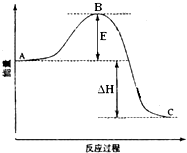
【答案】反应物总能量;无;降低;不变;﹣198
【解析】解:因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关;催化剂能够降低反应的活化能,不影响反应物和生成物能量高低,因1mol SO2(g)氧化为1mol SO3的△H=﹣99kJmol﹣1 , 所以2molSO2(g)氧化为2molSO3的△H=﹣198kJmol﹣1 , 则2SO2(g)+O2(g)=2SO3(g)△H=﹣198KJmol﹣1 , 所以答案是:反应物总能量;无;降低;不变;﹣198.
【考点精析】关于本题考查的反应热和焓变,需要了解在化学反应中放出或吸收的热量,通常叫反应热才能得出正确答案.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

