题目内容
【题目】有机物F可用于制造香精,可利用下列路线合成。

回答下列问题:
(1)![]() 分子中可能共面的原子最多有_____个;
分子中可能共面的原子最多有_____个;
(2)物质A的名称是______;
(3)物质D中含氧官能团的名称是_______;
(4)“反应④”的反应类型是______;
(5)写出“反应⑥”的化学方程式:________;
(6)C有多种同分异构体,与C中所含有的官能团相同的有_____种,其中核磁共振氢谱为四组峰的结构简式为 和_______。
和_______。
(7)参照上述合成路线,以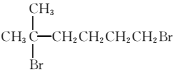 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线:_______________。
的合成路线:_______________。
【答案】 9 2-甲基-1,2-二溴丁烷 羧基 消去反应  11
11 
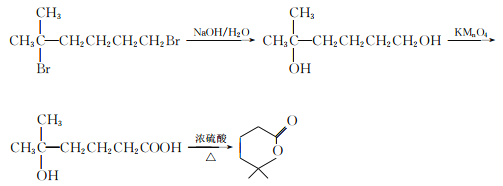
【解析】![]() 和溴水发生的是加成反应,根据加成产物可判断A的结构简式为CH2=C(H3)CHBrCH2Br ,反应②是水解反应,生成物B的结构简式为CH3CH2C(CH3)OHCH2OH.B氧化得到C,则C的结构简式为CH3CH2C(CH3)OHCOOH.根据C和D的分子式的可判断,反应④是消去反应,即D的结构简式为CH3CH= C(CH3)COOH,反应⑤属于卤代烃的水解反应,则E的结构简式为
和溴水发生的是加成反应,根据加成产物可判断A的结构简式为CH2=C(H3)CHBrCH2Br ,反应②是水解反应,生成物B的结构简式为CH3CH2C(CH3)OHCH2OH.B氧化得到C,则C的结构简式为CH3CH2C(CH3)OHCOOH.根据C和D的分子式的可判断,反应④是消去反应,即D的结构简式为CH3CH= C(CH3)COOH,反应⑤属于卤代烃的水解反应,则E的结构简式为![]() ,E和D通过酯化反应生成F,则F的结构简式为
,E和D通过酯化反应生成F,则F的结构简式为![]() ,
,
(1)![]() 分子中5个C,双键上的两个H,两个甲基上各有一个H,可能共面的原子最多有9个;
分子中5个C,双键上的两个H,两个甲基上各有一个H,可能共面的原子最多有9个;
(2)A物质CH2=C(CH3)CHBr CH2Br 的名称是2-甲基-1,2-二溴丁烷 ;
(3)D的结构简式为CH3CH=C(CH3)COOH,物质D中含氧官能团的名称是羧基;(4)消去水分子,“反应④”的反应类型是消去反应;(5)“反应⑥”是酯化反应,化学方程式: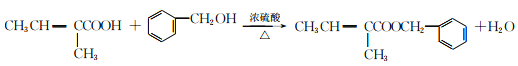
(6)C为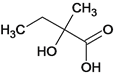 有多种同分异构体,与C中所含有的官能团相同的有11种
有多种同分异构体,与C中所含有的官能团相同的有11种 、
、 、
、 、
、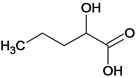 、
、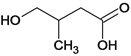 、
、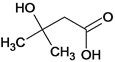 、
、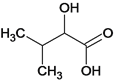 、
、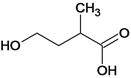 、
、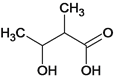 、
、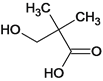 、
、 ;其中核磁共振氢谱为四组峰的结构简式为
;其中核磁共振氢谱为四组峰的结构简式为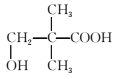 和
和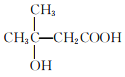 ;(7)以
;(7)以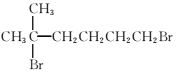
![]() 的合成路线,对比原料下产物,要将溴原子水解得―OH,再将末端的氧化成―COOH,最后再酯化成环,路线如下:
的合成路线,对比原料下产物,要将溴原子水解得―OH,再将末端的氧化成―COOH,最后再酯化成环,路线如下: 。
。

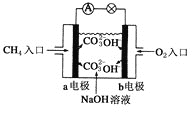
【题目】镍电池广泛应用于混合动力汽车系统,电极材料由NiO2、Fe和碳粉涂在铝箔上制成。放电过程中产生Ni(OH)2和Fe(OH)2,Fe(OH)2最终氧化、脱水生成氧化铁。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究。
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
M(OH)n | Ksp | pH | |
开始沉淀 | 沉淀完全 | ||
Al(OH)3 | 2.0×10-32 | 3.8 | —— |
Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
Fe(OH)2 | 8.0×10-16 | 6.95 | 9.95 |
Ni(OH)2 | 6.5×10-18 | 5.9 | 8.9 |
回答下列问题:
(1)该电池的负极材料是___________________,正极反应式为_________________,
(2)若电池输出电压为3V,给2W灯泡供电,当电池消耗0.02gFe,理论上电池工作__________min(小数点后保留2位)。(已知F=96500C/mol)
(3)将电池电极材料用盐酸溶解后加入适量双氧水,其目的是_____________。过滤,在滤液中慢慢加入NiO固体,则开始析出沉淀时的离子方程式是_______________和___________________。若将两种杂质阳离子都沉淀析出,pH应控制在___________(离子浓度小于或等于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.5);设计将析出的沉淀混合物中的两种物质分离开来的实验方案_____________。
(4)将加入NiO过滤后的溶液加入Na2C2O4,得到NiC2O4·2H2O和滤液A,A的主要成分是_____________;电解滤液A,在阴极产生气体B______(填分子式);在阳极产生气体C______(填分子式)。将NiC2O4·2H2O加入到电解后的溶液,再通入电解时某电解产生的气体,即可得到回收产品Ni(OH)3,所通入气体为______(填“B”、“C”)极气体,判断依据是_________。