题目内容
(6分)在4L的密闭容器中,充入1molN2和4molH2,在一定条件下反应,3分钟后达到平衡状态,相同温度下,测得平衡时气体的压强比反应前混合气体的压强减少了12%,则
(1)平衡时混合气体中三种气体的物质的量之比为 。
(2)N2的转化率为 。
(3)3分钟内NH3的平均反应速率为 。
(1)平衡时混合气体中三种气体的物质的量之比为 。
(2)N2的转化率为 。
(3)3分钟内NH3的平均反应速率为 。
(1)7:31:6 (2)30% (3)0.05 mol/(L·min)(每空2分)
考查可逆反应的有关计算,一般采用三段式。
N2+3H2 2NH3.
2NH3.
起始量(mol) 1 4 0
转化量(mol) x 3x 2x
平衡量(mol) 1-x 4-3x 2x
所以有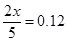
解得x=0.30mol
(1)因此平衡时混合气体中三种气体的物质的量之比为0.70︰3.1︰0.6=7:31:6
(2)N2的转化率为x÷1×100%=30%
(3)3分钟内NH3的平均反应速率为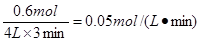
N2+3H2
 2NH3.
2NH3.起始量(mol) 1 4 0
转化量(mol) x 3x 2x
平衡量(mol) 1-x 4-3x 2x
所以有
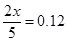
解得x=0.30mol
(1)因此平衡时混合气体中三种气体的物质的量之比为0.70︰3.1︰0.6=7:31:6
(2)N2的转化率为x÷1×100%=30%
(3)3分钟内NH3的平均反应速率为
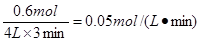

练习册系列答案
相关题目
 qD(g)的△H<0,m+n>q,在一个体积固定的密闭容器中反应达到平衡时,下列说法正确的是
qD(g)的△H<0,m+n>q,在一个体积固定的密闭容器中反应达到平衡时,下列说法正确的是 2AB(g)达到平衡状态的标志是( )
2AB(g)达到平衡状态的标志是( )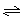 xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
 2 Z(g)。此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是( )
2 Z(g)。此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是( ) pC(g),达平衡后,若将气体体积扩大到原来的2倍。再达平衡时A的浓度是原来的0.8倍,则下列叙述正确的是
pC(g),达平衡后,若将气体体积扩大到原来的2倍。再达平衡时A的浓度是原来的0.8倍,则下列叙述正确的是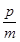 v逆(C)
v逆(C) 2AB(g)达到平衡标志的是
2AB(g)达到平衡标志的是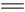 C(g) +D(g) △H-T△S="(-4500+11T)" J/mol,要防止反应发生,温度必须:
C(g) +D(g) △H-T△S="(-4500+11T)" J/mol,要防止反应发生,温度必须: