题目内容
【题目】化石燃料燃烧时会产生 SO2进入大气,有多种方法可用于 SO2的脱除。
(1)NaClO 碱性溶液吸收法。工业上可用 NaClO 碱性溶液吸收SO2。
①反应离子方程式是__________________________________________。
②为了提高吸收效率,常用 Ni2O3作为催化剂。在反应过程中产生的四价镍和氧原子具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如图所示:
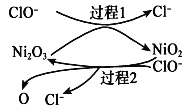
a.过程1的离子方程式是Ni2O3+ClO- =2NiO2 +Cl-,则过程2的离子方程式____________。
b.Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是________________。
(2)碘循环工艺也能吸收SO2降低环境污染,同时还能制得氢气,具体流程如下:
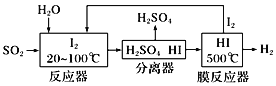
则碘循环工艺的总反应为:___________________________________________。
【答案】ClO-+SO2+2OH-=Cl-+SO42-+H2O 2NiO2+ClO- =Ni2O3 +Cl-+2O Ca2+与SO42—结合生成微溶的CaSO4有利于反应的进行 SO2+2H2O![]() H2SO4+H2
H2SO4+H2
【解析】
(1)二氧化硫排放到大气中易形成酸雨,需对其进行处理,可根据二氧化硫的还原性,采用氧化还原反应对其进行处理,次氯酸根具有氧化性,在碱性条件下可将二氧化硫氧化为硫酸根离子,催化剂可提高此反应速率,催化剂参加反应,但反应后催化剂没有变化,采用Ca(ClO)2也可吸收二氧化硫并且反应后生成微溶物硫酸钙,效果更好。
(2)通过流程图可看出反应器中发生的反应为:SO2+2H2O+I2 =H2SO4+2HI,在分离器中分离出硫酸后,HI进入到膜反应器中高温分解为氢气和碘单质,反应为2HI=I2+H2,经过一系列反应碘单质没有发生变化,因此可推断碘单质为此反应的催化剂。
(1)①用NaClO碱性溶液吸收SO2,次氯酸根将二氧化硫氧化生成硫酸根离子,离子方程式是ClO-+SO2+2OH- =Cl-+SO42-+H2O;
②a.为了提高吸收效率,常用Ni2O3作为催化剂,根据催化过程的示意图可知,过程2中NiO2和ClO-反应生成Ni2O3、Cl-、O,离子方程式为2NiO2+ClO- =Ni2O3 +Cl-+2O;
b.Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,是因为Ca2+与SO42—结合生成微溶的CaSO4,有利于反应的进行;
③通过流程图可看出,经过一系列反应碘单质没有发生变化,因此可推断碘单质为此反应的催化剂,二氧化硫与水发生氧化还原反应生成硫酸和氢气,反应方程式为:SO2+2H2O![]() H2SO4+H2。
H2SO4+H2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知2A(g)+B(g)![]() 2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。
2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。
(1)已知:A(g)+X(g)![]() 2B(g) ΔH=-133.2 kJ·mol-1;
2B(g) ΔH=-133.2 kJ·mol-1;
5A(g)+X(g)![]() 4C(g) ΔH=-650.4 kJ·mol-1。则a=________。
4C(g) ΔH=-650.4 kJ·mol-1。则a=________。
(2)不同温度下该反应的平衡常数如表所示。由此可推知,表中T1________T2(填“>”“=”或“<”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2 mol C,500 ℃时充分反应达平衡后,吸收热量为c kJ,C的浓度________________ω mol·L-1(填“>”“=”或“<”),a、b、c之间的关系为________________。
(3)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是________(填序号)。
A.4 mol A和2 mol B
B.4 mol A、2 mol B和2 mol C
C.4 mol A和4 mol B
D.6 mol A和4 mol B
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,放出的热量为d kJ,则d________b(填“>”“=”或“<”),理由是____________________________________。
(5)在一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,充分反应,平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,则平衡时A的百分含量________(填“不变”“变大”“变小”或“无法确定”)。