题目内容
6.通常要用氧化剂才能实现的反应是( )| A. | NaCl→HCl | B. | Cl2→HCl | C. | Cl-→Cl2 | D. | ClO3-→Cl2 |
分析 加入适当的氧化剂才能实现,则选项中为还原剂发生的氧化反应,还原剂中某元素的化合价升高,以此来解答.
解答 解:A.元素化合价没有发生变化,不是氧化还原反应,故A错误;
B.Cl元素化合价降低,被还原,应加入还原剂,故B错误;
C.Cl元素化合价升高,被氧化,应加入氧化剂,故C正确;
D.Cl元素化合价降低,被还原,应加入还原剂,故D错误.
故选C.
点评 本题考查氧化还原反应,明确元素化合价与反应类型的关系是解本题关键,知道常见元素化合价,题目难度不大.

练习册系列答案
相关题目
16.某小组为研究电化学原理,设计如图装置,下列叙述正确的是( )
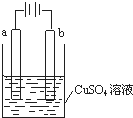

| A. | 若a和b为石墨,通电后a电极上发生的反应为Cu2++2e-═Cu | |
| B. | 若a和b为铜,通电后a电极有气体产生 | |
| C. | 若a为铜,b为铁,通电后Cu2+向a电极移动 | |
| D. | 若a为粗铜,b为纯铜,通电后b电极质量增加 |
17.常温下,下列各组离子在指定的溶液中一定能大量共存的是( )
| A. | pH>7的溶液中:Na+、K+、SO${\;}_{3}^{2-}$、CO${\;}_{3}^{2-}$ | |
| B. | 无色透明溶液中:H+、Ca2+、Cl-、AlO2- | |
| C. | 含大量Fe3+的溶液中:K+、I-、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ | |
| D. | 与Al反应放出H2的溶液中:NH${\;}_{4}^{+}$、Na+、NO${\;}_{3}^{-}$、F- |
18.1mol CH4与Cl2发生光照下反应,生成相同物质的量的4种取代物,则消耗的Cl2的物质的量为( )
| A. | 0.5 mol | B. | 2 mol | C. | 2.5 mol | D. | 4 mol |
16.在0.1mol/L的HA溶液中存在如下电离平衡:HA?A-+H+,对于该溶液,下列叙述正确的是( )
| A. | 滴加少量1.0mol/L HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减少 | |
| B. | 加水,溶液中c(H+)、c(A-)、c(HA)浓度均减小 | |
| C. | 加入少量NaA固体,平衡向逆反应方向移动,溶液中c(H+)增大 | |
| D. | 加入少量NaOH固体,平衡向正反应方向移动,溶液中c(H+)增大 |
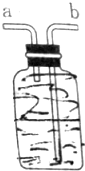 如图所示装置,用排空气法收集O2,O2应由b(填“a”或“b”下同)口进入,检验O2是否收集满的操作是将带火星的木条靠近a,如果带火星木条复燃,证明氧气收集满;若想用排水法收集O2,可将装置中充满水,O2由a口进入.
如图所示装置,用排空气法收集O2,O2应由b(填“a”或“b”下同)口进入,检验O2是否收集满的操作是将带火星的木条靠近a,如果带火星木条复燃,证明氧气收集满;若想用排水法收集O2,可将装置中充满水,O2由a口进入. ,二氯甲烷的结构式
,二氯甲烷的结构式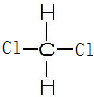 ,写出CH3(CH2)5CH3的名称:正庚烷.戊烷三种同分异构体的结构简式:CH3CH2CH2CH2CH3、CH3CH(CH3)CH2CH3、C(CH3)4.
,写出CH3(CH2)5CH3的名称:正庚烷.戊烷三种同分异构体的结构简式:CH3CH2CH2CH2CH3、CH3CH(CH3)CH2CH3、C(CH3)4.