题目内容
【题目】根据如图所示回答有关问题: 
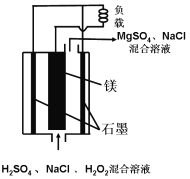
(1)甲池为(选填“原电池”或“电解池”),
(2)乙池中Zn棒上发生反应的电极反应式为: .
(3)石墨A上收集到1.12L气体(标况下),则反应过程中转移的电子数为 .
【答案】
(1)电解池
(2)Zn﹣2e﹣=Zn2+
(3)0.1NA
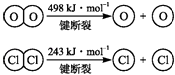
【解析】解:(1)甲池电极材料都为石墨,没有能自发进行的氧化还原反应发生,甲为电解池,所以答案是:电解池;(2)乙为原电池,锌为负极,发生氧化反应,电极方程式为Zn﹣2e﹣=Zn2+ , 所以答案是:Zn﹣2e﹣=Zn2+;(3)A连接乙的Cu棒,乙中铜为正极,则A为阳极,发生氧化反应,电极方程式为2Cl﹣﹣2e﹣═Cl2↑,则产生1molCl2转移电子2mol,当收集到1.12L气体(标况下),则反应过程中转移的电子物质的量为 ![]() ×2=0.1mol,数目为0.1NA , 所以答案是:0.1NA .
×2=0.1mol,数目为0.1NA , 所以答案是:0.1NA .

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
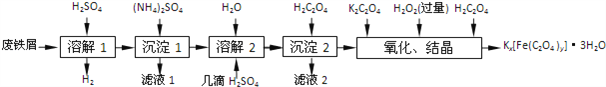
口算与应用题卡系列答案【题目】草酸合铁酸钾晶体Kx[Fe(C2O4)y]3H2O是一种光敏材料,下面是一种制备草酸合铁酸钾晶体的实验流程.
已知:(NH4)2SO4、FeSO47H2O、莫尔盐[(NH4)2SO4FeSO46H2O]的溶解度如下表:
温度/℃ | 10 | 20 | 30 | 40 | 50 |
(NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
FeSO47H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | ﹣ |
(NH4)2SO4FeSO46H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(1)“溶解1”应保证铁屑稍过量,其目的是______.“溶解2”加“几滴H2SO4”的作用是______.
(2)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、______、过滤、用乙醇洗涤、干燥.用乙醇洗涤的目的是______.
(3)“沉淀”时得到的FeC2O42H2O沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是______.
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是______.
(5)请补全测定草酸合铁酸钾产品中Fe3+含量的实验步骤【备选试剂:KMnO4溶液、锌粉、铁粉、NaOH溶液】:
步骤1:准确称取所制备的草酸合铁酸钾晶体a g,配成250mL待测液.
步骤2:用移液管移取25.00mL待测液于锥形瓶中,加入稀H2SO4
步骤3:向步骤2所得溶液中______加热至充分反应(溶液黄色刚好消失),过滤、洗涤、将过滤及洗涤所得溶液收集到锥形瓶中.
步骤4:用c molL﹣1 KMnO4标准溶液滴定步骤3所得溶液至终点,消耗V mL KMnO4标准溶液.