题目内容
【题目】开发新型高效的乙烷脱氢制乙烯过程对于石油化工至关重要。回答下列问题:
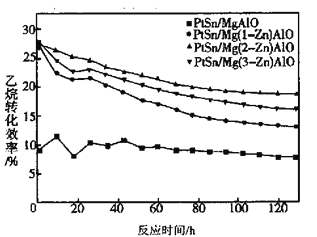
(1)不同Zn含量PtSn催化剂催化乙烷脱氢反应![]()
![]() 时,乙烷的转化效率随时间变化如下图所示。由图可知,催化活性最优的催化剂为____________。
时,乙烷的转化效率随时间变化如下图所示。由图可知,催化活性最优的催化剂为____________。
(2)随着温度升高,乙烷脱氢反应容易造成催化剂表面积碳,影响催化剂的稳定性,脱氢时通常一起充入CO2,该工艺称为“乙烷二氧化碳氧化脱氢反应”,CO2发生的反应为:![]()
![]() 、
、![]()
![]() 。则CO2的作用为____________、____________。
。则CO2的作用为____________、____________。
(3)实验室模拟“乙烷二氧化碳氧化脱氢反应”,![]() ℃时,将2.8mol
℃时,将2.8mol![]() 与5.2mol CO2充入容积恒定为0.5L的恒温密闭容器中发生反应:
与5.2mol CO2充入容积恒定为0.5L的恒温密闭容器中发生反应:![]()
![]() ,平衡时,
,平衡时,![]() 。
。
①a=______。
②T℃时,该反应的平衡常数K=______。
③若不考虑副反应,对于该反应体系,下列说法正确的是______(填标号)。
a.三种生成物平衡分压比值保持不变时,反应达到平衡状态
b.降低C2H6与CO2用料比,C2H6的平衡转化率升高
c.在容器中加入CaO,可与H2O反应,提高CH2=CH2产率
d.反应开始后的一段时间内,适当缩小容器体积可提高单位时间内C2H6的转化率
(4)中国科学院科研团队,利用固体氧化物电解池(Solid oxide electrolysis cell,SOEC),在SOEC阳极实现了高选择性乙烷电化学脱氢制乙烯。装置示意图如下。

①b为电源的______极。
②阳极电极反应为__________________。
【答案】PtSn/Mg(2-Zn)AlO 消耗H2促进乙烷脱氢反应正向进行 消除催化剂表面积碳,提高催化剂的稳定性 +178.1 6.25 mol/L bd 负 ![]()
【解析】
(1)由图象看出最高的那条线是催化活性最优的,即PtSn/Mg(2-Zn)AlO催化剂的催化反应活性最优;
(2)根据CO2发生的反应,结合题干信息思考;
(3)用盖斯定律计算出目标方程式的反应热,再利用三段式法计算平衡常数;
(4)二氧化碳通过电解转变为一氧化碳,碳元素化合价降低,得电子,被还原,则与b相连的电极为阴极,与a相连的电极为阳极,与阴极相连的为电源负极,则a为电源正极,b为电源负极。
(1)由图象看出最高的那条线是催化活性最优的,即PtSn/Mg(2-Zn)AlO催化剂的催化反应活性最优,故答案为:PtSn/Mg(2-Zn)AlO;
(2)根据CO2发生的反应分析,![]() ,消耗了H2,有利于乙烷的脱氢反应向右进行;
,消耗了H2,有利于乙烷的脱氢反应向右进行;![]() ,能消除积碳,提高催化剂的稳定性,故答案为:消耗H2促进乙烷脱氢反应正向进行;消除催化剂表面积碳,提高催化剂的稳定性;
,能消除积碳,提高催化剂的稳定性,故答案为:消耗H2促进乙烷脱氢反应正向进行;消除催化剂表面积碳,提高催化剂的稳定性;
(3)①由盖斯定律,根据已知的方程式:
①![]()
![]() ;
;
②![]()
![]() ;
;
根据盖斯定律,将①+②得到![]() H=+136.9kJ/mol+41.2kJ/mol=+178.1 kJ/mol,故答案为:+178.1;
H=+136.9kJ/mol+41.2kJ/mol=+178.1 kJ/mol,故答案为:+178.1;
②设转化C2H6物质的量为xmol,根据题目数据,列式如下:
![]()
起始(mol)2.8 5.2 0 0 0
转化(mol)x x x x x
平衡(mol)2.8-x 5.2-x x x x
又因为是恒容容器,压强之比等于物质的量之比,![]() ,有
,有![]() ,解得x=2,又容器体积为0.5L,故平衡时各组分的浓度为:c(C2H6)=
,解得x=2,又容器体积为0.5L,故平衡时各组分的浓度为:c(C2H6)=![]() ,c(CO2)=
,c(CO2)=![]() ,c(CH2=CH2)= c(CO)=c(H2O)=
,c(CH2=CH2)= c(CO)=c(H2O)=![]() ,该反应的平衡常数K=
,该反应的平衡常数K=![]() =
=![]() =6.25mol/L,故答案为:6.25mol/L;
=6.25mol/L,故答案为:6.25mol/L;
③a.由方程式看出,三种生成物的化学计量数均为1,三种生成物平衡分压比值始终保持不变,三种生成物平衡分压比值保持不变时,不能说明反应达到平衡状态,故a错误;
b.降低C2H6与CO2用料比,相当于增大CO2的量,可以使C2H6的平衡转化率升高,故b正确;
c.在容器中加入CaO,CO2先与CaO反应,平衡逆向移动会降低CH2=CH2产率,故c错误;
d.适当缩小容器体积,压强增大,反应速率加快,可提高单位时间内C2H6的转化率,故d正确。
故答案为:bd;
(4)①根据分析可知,b为电源的负极,故答案为:负;
②阳极发生氧化反应,乙烷失电子变成乙烯,固体电解质可以传导O2-,电极反应式为:![]() ,故答案为:
,故答案为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】查阅资料:元素铬(Cr)在溶液中主要以Cr3+(蓝紫色) 、Cr(OH)4-(绿色) 、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)铬(24Cr)属于________(选填编号)。
a.主族元素 b.副族元素 c.Ⅶ族元素 d.过渡元素
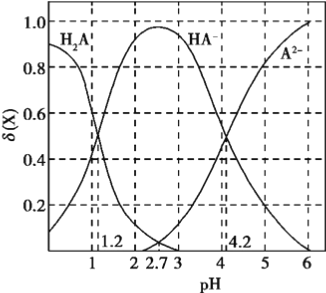
(2)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
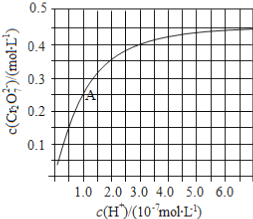
①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH_________0(填“>”“<”或“=”)。
(3)欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.已知:
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.2 |
Cr3+ | 6.0 | 8.0 |
某含铬废水处理的主要流程如图所示:
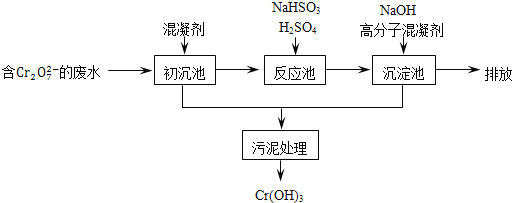
①初沉池中加入的混凝剂是K2SO4﹒Al2(SO4)3﹒24H2O,其作用为__________(用离子方程式表示).
②反应池中用NaHSO3将酸性废液中的Cr2O72-还原成Cr3+,该反应的离子方程式为________.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子的先后顺序是____________.证明Cr3+沉淀完全的方法是__________.
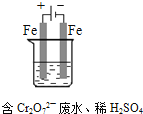
(4)工业可用电解法来处理含 Cr2O72-废水.实验室利用如图模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-═H2↑.Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是__________,得到的金属阳离子在阴极区可沉淀完全,用电解法处理该溶液中0.01mol Cr2O72-时,至少得到沉淀的质量是__________ g.