题目内容
【题目】查阅资料:元素铬(Cr)在溶液中主要以Cr3+(蓝紫色) 、Cr(OH)4-(绿色) 、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)铬(24Cr)属于________(选填编号)。
a.主族元素 b.副族元素 c.Ⅶ族元素 d.过渡元素
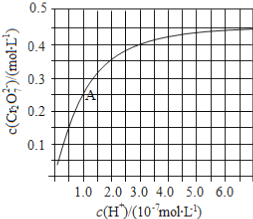
(2)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH_________0(填“>”“<”或“=”)。
(3)欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.已知:
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.2 |
Cr3+ | 6.0 | 8.0 |
某含铬废水处理的主要流程如图所示:
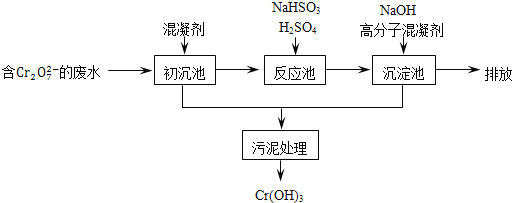
①初沉池中加入的混凝剂是K2SO4﹒Al2(SO4)3﹒24H2O,其作用为__________(用离子方程式表示).
②反应池中用NaHSO3将酸性废液中的Cr2O72-还原成Cr3+,该反应的离子方程式为________.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子的先后顺序是____________.证明Cr3+沉淀完全的方法是__________.
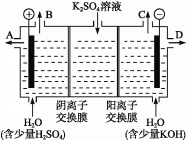
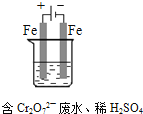
(4)工业可用电解法来处理含 Cr2O72-废水.实验室利用如图模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-═H2↑.Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是__________,得到的金属阳离子在阴极区可沉淀完全,用电解法处理该溶液中0.01mol Cr2O72-时,至少得到沉淀的质量是__________ g.
【答案】 bd 2CrO42-+2H+![]() Cr2O72- +H2O 增大 K=1.0×1014 < Al3+ + 3H2O
Cr2O72- +H2O 增大 K=1.0×1014 < Al3+ + 3H2O![]() Al(OH)3(胶体) + 3H+ Cr2O72- +3HSO3- +5H+===2Cr3++3SO42- +4H2O H+、Cr3+ 测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全(其他合理答案均可) 6Fe2++Cr2O72- +14H+===6Fe3++2Cr3++7H2O 8.48
Al(OH)3(胶体) + 3H+ Cr2O72- +3HSO3- +5H+===2Cr3++3SO42- +4H2O H+、Cr3+ 测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全(其他合理答案均可) 6Fe2++Cr2O72- +14H+===6Fe3++2Cr3++7H2O 8.48
【解析】(1)Cr是ⅥB族的金属元素,所以是副族元素也是过渡元素。
(2)①图中看到:酸性增强时CrO42转化为Cr2O72,所以方程式为:2CrO42+2H+![]() Cr2O72- +H2O。②酸性增强,氢离子浓度增大,平衡正向移动,CrO42的平衡转化率增大。A点Cr2O72-的浓度为0.25mol/L,则消耗的CrO42-的浓度为0.5mol/L,则溶液中的c(CrO42-)=1.0mol/L - 0.25mol/L×2 = 0.5mol/L,H+浓度为1×10-7mol/L,此时该转化反应的平衡常数为
Cr2O72- +H2O。②酸性增强,氢离子浓度增大,平衡正向移动,CrO42的平衡转化率增大。A点Cr2O72-的浓度为0.25mol/L,则消耗的CrO42-的浓度为0.5mol/L,则溶液中的c(CrO42-)=1.0mol/L - 0.25mol/L×2 = 0.5mol/L,H+浓度为1×10-7mol/L,此时该转化反应的平衡常数为 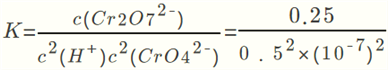 ,即K=1×1014。③升高温度,溶液中CrO42的平衡转化率减小,说明平衡逆向移动,则该反应的ΔH<0。
,即K=1×1014。③升高温度,溶液中CrO42的平衡转化率减小,说明平衡逆向移动,则该反应的ΔH<0。
(3)①加入明矾的目的是铝离子水解得到氢氧化铝胶体,再吸附水中其他不溶物一起聚沉,所以反应为:Al3+ + 3H2O![]() Al(OH)3(胶体) + 3H+。
Al(OH)3(胶体) + 3H+。
②用NaHSO3将酸性废液中的Cr2O72-还原成Cr3+,同时+4价S化合价应该升高到+6价,得到硫酸根根,所以方程式为:Cr2O72- +3HSO3- +5H+===2Cr3++3SO42- +4H2O。沉淀池溶液中主要存在氢离子和Cr3+,加入氢氧根离子,应该先进行酸碱中和,再形成氢氧化铬沉淀,所以先反应H+再反应Cr3+。从题目的表格中已知:pH达到8的时候溶液中的Cr3+完全沉淀,所以可以利用测定溶液pH的方法来证明Cr3+完全沉淀。
(4)Cr2O72-将Fe2+氧化为Fe3+,本身还原为Cr3+,所以反应方程式为:6Fe2++Cr2O72- +14H+===6Fe3++2Cr3++7H2O。根据上述方程式,处理该溶液中0.01molCr2O72-时,应该得到0.02molCr3+和0.06molFe3+,题目说得到的金属阳离子在阴极区可沉淀完全,则Cr3+和Fe3+应该完全沉淀,得到0.02molCr(OH)3和0.06molFe(OH)3,质量为0.02×(52+17×3) + 0.06×(56+17×3)=8.48g。