题目内容
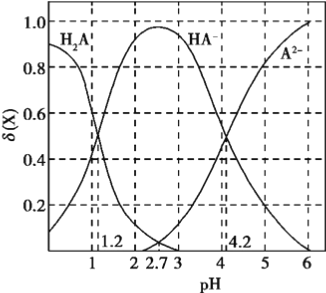
【题目】改变0.1mol/L二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数![]() 随pH的变化如图所示已知[
随pH的变化如图所示已知[![]() ]。
]。
下列叙述错误的是
A. lg[K2(H2A)]=-4.2
B. pH=4.2时,c(HA-) = c(A2-) = c(H+)
C. pH=2.7时,c(HA-)>c(H2A)= c(A2-)
D. pH=1.2时,c(H2A)=c(HA-)
【答案】B
【解析】K2(H2A)= 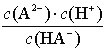 ,结合题图中pH=4.2时c(HA-)=c(A2-),代入上式可得K2(H2A)=10-4.2,则lg[K2(H2A)]=-4.2,选项A正确。pH=4.2时,c(H+)=10-4.2 mol·L-1,但溶液中c(HA-)、c(A2-)均约为0.05 mol·L-1(图中看到这两个成分浓度相等,综合应该还是0.1mol/L),选项B错误。从图中可以得到pH=2.7时,c(HA-)较大,c(H2A)= c(A2-)且都较低,所以选项C正确。从图中得到H2A和HA-的
,结合题图中pH=4.2时c(HA-)=c(A2-),代入上式可得K2(H2A)=10-4.2,则lg[K2(H2A)]=-4.2,选项A正确。pH=4.2时,c(H+)=10-4.2 mol·L-1,但溶液中c(HA-)、c(A2-)均约为0.05 mol·L-1(图中看到这两个成分浓度相等,综合应该还是0.1mol/L),选项B错误。从图中可以得到pH=2.7时,c(HA-)较大,c(H2A)= c(A2-)且都较低,所以选项C正确。从图中得到H2A和HA-的![]() 相等,则两者的浓度一定相等,选项D正确。
相等,则两者的浓度一定相等,选项D正确。

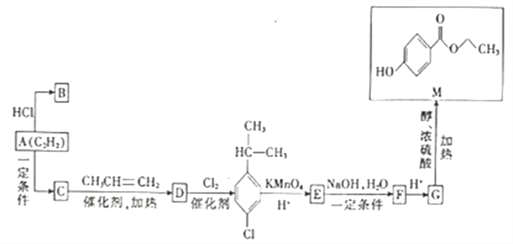
【题目】利用化肥生产中的废催化剂(主要成分为Al2O3、K2O、少量的CoO、SiO2等)来制取明矾的工艺流程如图所示。
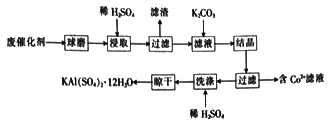
(1)KAl(SO4)2 12H2O中A1的化合价为__________。
(2)废催化剂在浸取前进行球磨的主要目的是______________。
(3)浸取时Al2O3溶解的化学方程式为_________;滤渣的主要成分是______________ (填化学式)。
(4)实验测得K2CO3的加入量与KA1(SO4)2 12H2O产率及纯度关系如下表所示:
编号 | 1 | 2 | 3 | 4 |
K2CO3加入量/g | 2 | 4 | 6 | 8 |
产品质量/g | 3.3 | 5.7 | 4.6 | 4.5 |
明矾纯度/% | 99.1 | 98.2 | 91.4 | 84.9 |
当K2CO3的加入量超过4 g后,晶体的质量减少且纯度降低,其原因是__________________。
【题目】甲和乙两种物质混合反应(反应可加热),将所得气体通入适量的丙中,丙中没有明显现象产生的是 ( )
选项 | 甲 | 乙 | 丙 |
A | C | 浓硫酸 | 澄清石灰水 |
B | MnO2 | 稀盐酸 | 品红溶液 |
C | 浓氨水 | 碱石灰 | AlCl3溶液 |
D | Cu | 浓硝酸 | Ba(HSO3)2溶液 |
A. A B. B C. C D. D