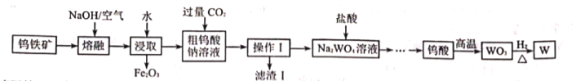
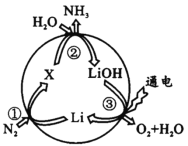
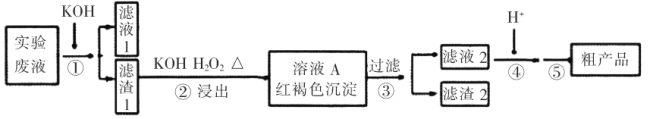
题目内容
【题目】某实验室废液含![]() 等离子,现通过如下流程变废为宝制备
等离子,现通过如下流程变废为宝制备![]() 。
。
已知:(a)![]()
![]() (黄色)
(黄色)
(b)金属离子形成氢氧化物沉淀的pH范围如表。
金属离子 | pH | |
沉淀 | 沉淀 | |
Fe3+ | 2.7 | 3.7 |
Cr3+ | 4.9 | 6.8 |
请回答:
(1)如在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是:_________________。
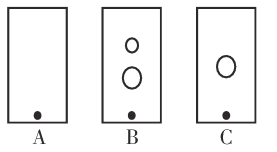
(2)某同学采用纸层析法判断步骤①加入KOH的量是否合适。在加入一定量KOH溶液后,用毛细管取样、点样、薄层色谱展开、氨熏后的点如图所示。加入KOH最适合的实验编号是(上图ABC中选择,实验顺序已乱)_________________,C的斑点颜色为_________________。
(3)步骤②含Cr物质发生的主要反应的离子方程式为_________________。
(4)在下列装置中,步骤②应选用实验装置是_________________。(填标号)
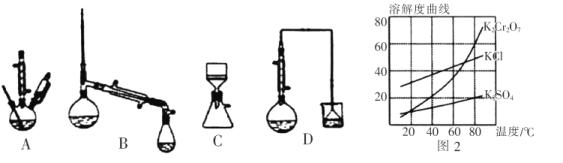
(5)部分物质的溶解度曲线如图2,步骤⑤可能用到下列部分操作:a.蒸发至出现大量晶体,停止加热;b.冷却至室温;c.蒸发至溶液出现晶膜,停止加热;d.洗涤;e.趁热过滤;f.抽滤。请选择合适操作的正确顺序_________________。
(6)步骤⑤中合适的洗涤剂是_________________(“无水乙醇”、“乙醇-水混合液”、“热水”、“冰水”),粗产品进一步提纯的方法是_________________。
(7)取mg粗产品配成250mL溶液,取25.00mL于锥形瓶中,用cmol.L-1的![]() 标准溶液滴定(杂质不反应),消耗标准
标准溶液滴定(杂质不反应),消耗标准![]() 溶液VmL,则该粗产品中
溶液VmL,则该粗产品中![]() 的纯度为_________________。(
的纯度为_________________。(![]() 的式量:294)
的式量:294)
【答案】固体溶解;产生无色有刺激性气味的气体;溶液由橙色变黄色 A 黄色 ![]() A aebfd 冰水 重结晶
A aebfd 冰水 重结晶 ![]()
【解析】
某实验室废液含![]() 等离子,加入KOH,可生成Fe(OH)3、Cr(OH)3沉淀,沉淀加入过氧化氢,发生氧化还原反应生成
等离子,加入KOH,可生成Fe(OH)3、Cr(OH)3沉淀,沉淀加入过氧化氢,发生氧化还原反应生成![]() ,过滤,红褐色沉淀为Fe(OH)3,加入酸可生成K2Cr2O7,由图1可知,蒸发至出现大量晶体,停止加热,趁热过滤除去KCl等,然后冷却至室温、抽滤、洗涤可得到K2Cr2O7,以此解答该题。
,过滤,红褐色沉淀为Fe(OH)3,加入酸可生成K2Cr2O7,由图1可知,蒸发至出现大量晶体,停止加热,趁热过滤除去KCl等,然后冷却至室温、抽滤、洗涤可得到K2Cr2O7,以此解答该题。
(1)如在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓KOH溶液,振荡、微热,两者反应生成氨气和铬酸钾,因此可观察到固体溶解,产生无色有刺激性气味的气体,溶液由橙色变黄色的现象,故答案为:固体溶解;产生无色有刺激性气味的气体;溶液由橙色变黄色;
(2)加入氢氧化钠最适合时,Fe3+、Cr3+恰好生成沉淀,则A为合适,再加入一定量KOH溶液后,用毛细管取样、点样、薄层色谱展开、氨熏后发生Cr3++6NH3=[Cr(NH3)6]3+(黄色),则C的斑点呈黄色,故答案为:A;黄色;
(3)根据分析可知步骤②含Cr物质被氧化,发生的主要反应的离子方程式为2Cr(OH)3+3H2O2+4OH-=2![]() +8H2O,故答案为:2Cr(OH)3+3H2O2+4OH-=2
+8H2O,故答案为:2Cr(OH)3+3H2O2+4OH-=2![]() +8H2O;
+8H2O;
(4)步骤②反应需要加热,且反应中需要加入液体,因此选用A装置;故答案为:A;
(5)步骤⑤由溶液得到晶体,实验时,蒸发至出现大量晶体,停止加热,趁热过滤除去KCl等,然后冷却至室温、抽滤、洗涤可得到K2Cr2O7,则顺序为aebfd,故答案为:aebfd;
(6)K2Cr2O7具有强氧化性,不能用乙醇洗涤,在温度较低时溶解度较小,则用冷水洗涤,可采用重结晶的方法对粗产品进一步提纯,故答案为:冰水;重结晶;
(7)该滴定实验的滴定原理为利用Fe2+使![]() 完全转化为Cr3+,二者数量关系为
完全转化为Cr3+,二者数量关系为
![]() ~6Fe2+,滴定过程消耗的n(Fe2+)=cV/1000mol,故待测液中K2Cr2O7物质的量为
~6Fe2+,滴定过程消耗的n(Fe2+)=cV/1000mol,故待测液中K2Cr2O7物质的量为![]() mol,所以样品中K2Cr2O7物质的量为
mol,所以样品中K2Cr2O7物质的量为![]() mol,质量为
mol,质量为![]() g,所以质量分数为:
g,所以质量分数为:![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。

【题目】硫化氢(H2S)是一种无色具有臭鸡蛋气味、能溶于水的高毒性的化合物,其广泛存在化石燃料加工的尾气中。为避免污染环境,可用活性炭材料进行脱硫,脱硫的方法有物理吸附法、化学吸附法和氧化法。
(1)物理吸附法:
物理吸附法是先将尾气缓缓通过活性炭,将H2S从尾气中转移到活性炭的微孔或表面,这是利用活性炭的___性。
(2)氧化法:
利用吸附在活性炭表面上的活性氧(O),将H2S氧化成S而除去,该反应的化学方程式是___。
(3)化学吸附法:
①利用H2S能溶于水,形成硫化氢溶液,更易被活性炭吸附。若0.1molL-1H2S的pH约为4,则H2S在水溶液中的电离方程式是___,被吸附的离子主要有___。
②工业生产中用CuCl2溶液处理活性炭的工艺称为活性炭的改性,改性后的活性炭能提高化学吸附法中H2S的吸收量。
i.用不同浓度的CuCl2溶液改性后的活性炭对H2S吸附量的影响如图所示。随着CuCl2溶液浓度的升高,活性炭对硫化氢吸附量不再增加,原因是过多金属离子阻塞活性炭内部的微孔结构,导致活性炭的吸附能力下降。改性后的活性炭,能提高H2S吸附量的原因是___(用离子方程式表示)。
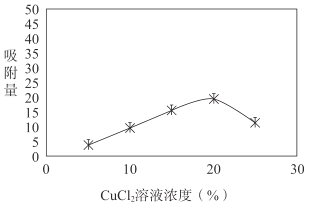
ii.水膜处理对活性炭吸附H2S量也有影响。测定含水量不同时,活性炭对硫化氢吸附量的影响,实验结果如下表。
载水率(%) | 0 | 5.32 | 10.23 | 15.33 | 20.19 |
吸附量(mg/g—活性炭) | 19.62 | 21.52 | 32.42 | 31.28 | 30.78 |
注:载水率即单位质量的活性炭吸附水的质量。
活性炭载水率为10%以上时,吸附量降低,其可能的原因是___。
(4)下列关于活性炭处理H2S尾气的说法正确的是___(选填字母序号)。
a.化学吸附过程中存在着电离平衡的移动
b.活性炭改性时,CuCl2溶液的浓度越大,H2S的吸附量越大
c.其他条件相同时,低温、缓慢通入尾气更有利于H2S的物理吸附
d.适当提高活性炭的载水率,可提高H2S吸附量的原因是活性炭吸附离子比吸附分子能力更强