��Ŀ����
����Ŀ��H��C��N��O����������Ȼ���г����ǽ���Ԫ�أ�
��1��O��C��N����Ԫ�صĵ�һ��������С����˳������NH4+�е�ԭ�ӹ�����ӻ�����Ϊ ��
��2��CO��N2�Ľṹ�ɱ�ʾΪ��C��O��N��N���ߵļ������ݣ�����λkJ/mol��
A��B | A=B | A��B | |
CO | 357.7 | 798.9 | 1071.9 |
N2 | 154.8 | 418.4 | 941.7 |
�������˵��CO��N2���õ�ԭ�� ��
��3���Ҷ�����H2N��CH2��CH2��NH2�������װ�[N��CH3��3]�����ڰ������Ҷ��������װ��ķе�ߵĶ࣬ԭ���� ��
��4��C��NԪ���γɵ��²��Ͼ�������ͼ��ʾ�ṹ���þ���Ӳ�Ƚ�����Ŀǰ��������Ӳ�Ľ��ʯ����Ϊ����һָ�ij�Ӳ�²��ϣ������ʵĻ�ѧʽΪ�� �� 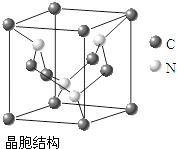
���𰸡�
��1��C O N��sp3�ӻ�
��2��CO�ĵ�һ���м��ļ���Ϊ273kJ/mol��N2�еĵ�һ���м��ļ���Ϊ523.3kJ/mol������CO�ĵ�һ������N2��������
��3���Ҷ������Ӽ�����γ���������װ����Ӽ䲻���γ����
��4��C3N4
���������⣺��1��ͬһ����Ԫ�صĵ�һ����������ԭ�����������������������ƣ�����IIA��͵�VA��Ԫ�صĵ�һ�����ܴ�������Ԫ�أ�����C��N��O����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ��N��O��C��NH4+�е�ԭ�Ӻ���4�����ۼ��������������ӻ�����sp3�ӻ���
���Դ��ǣ�N��O��C��sp3�ӻ�����2�����ݱ������ݿ�֪������C��O�е�һ���м����ĵ�������1071.9kJ/mol��798.9kJ/mol=273kJ/mol������N��N�е�һ���м����ĵ�������941.7kJ/mol��418.4kJ/mol=523.3kJ/mol������һ���м�CO��N2�����ף�����CO�����ã�
���Դ��ǣ�CO�ĵ�һ���м��ļ���Ϊ273kJ/mol��N2�еĵ�һ���м��ļ���Ϊ523.3kJ/mol������CO�ĵ�һ������N2�������ѣ���3���Ҷ�����H2N��CH2��CH2��NH2������֮������γ���������װ�[N��CH3��3]����֮�䲻���γ���������Ҷ����ķе�ϸߣ�
���Դ��ǣ��Ҷ������Ӽ�����γ���������װ����Ӽ䲻���γ��������4���þ����к���̼ԭ�Ӹ���=8�� ![]() +4��
+4�� ![]() =3��Nԭ�Ӹ���Ϊ4�������仯ѧʽΪC3N4 �� ���Դ��ǣ�C3N4 ��
=3��Nԭ�Ӹ���Ϊ4�������仯ѧʽΪC3N4 �� ���Դ��ǣ�C3N4 ��
�����㾫����ͨ�������������Ĵ��ڶ��������ʵ�Ӱ�죬���������Ҫ������HF��H2O��NH3��CH3CH2OH���Ӽ䣻��HF��H2O��NH3�ķе�ֱ���ͬ���⻯��е���ȷ����ĸ����Խ����⣮

 �����ҵ��ٿ���������������ϵ�д�
�����ҵ��ٿ���������������ϵ�д�