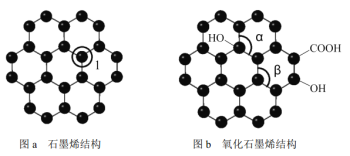
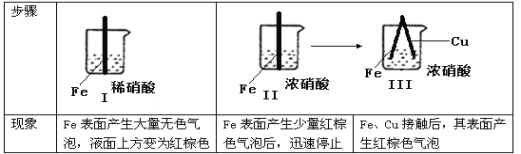
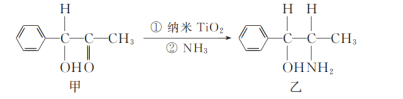
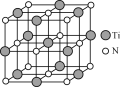
题目内容
【题目】FeCl3在现代工业生产中应用广泛.某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
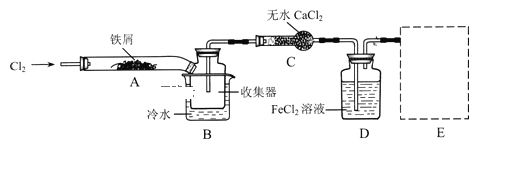
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④…
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封.
请回答下列问题:
(1)装置A中反应的化学方程式为 _______________________
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端.要使沉积的FeCl3进入收集器,第④步操作是 ________________________
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号) _________________________
(4)装置B中冷水浴的作用为;_________装置C的名称为 ______________;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:__________________________
(5)在虚线框中尾气吸收装置E所用试剂为____________________________
(6)用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
V.浓缩、结晶、分离,得到产品。
已知:金属离子的起始浓度为0.1mol·L-1
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤Ⅱ的目的:______________________________________________________
【答案】2Fe+3Cl2![]() 2FeCl3 在沉积的氯化铁固体下方加热 ②通入干燥的Cl2 ⑤用干燥的N2赶尽Cl2 冷却FeCl3使其沉积,便于收集产品 干燥管 K3[Fe(CN)6]溶液,或酸性高锰酸钾溶液 氢氧化钠溶液 将Fe2+全部氧化为 Fe3+,调节pH将Fe3+全部转化为沉淀
2FeCl3 在沉积的氯化铁固体下方加热 ②通入干燥的Cl2 ⑤用干燥的N2赶尽Cl2 冷却FeCl3使其沉积,便于收集产品 干燥管 K3[Fe(CN)6]溶液,或酸性高锰酸钾溶液 氢氧化钠溶液 将Fe2+全部氧化为 Fe3+,调节pH将Fe3+全部转化为沉淀
【解析】
(1)装置A中铁与氯气发生反应制取氯化铁,反应的化学方程式为2Fe+3Cl2![]() 2FeCl3;答案为:2Fe+3Cl2
2FeCl3;答案为:2Fe+3Cl2![]() 2FeCl3;
2FeCl3;
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端.要使沉积的FeCl3进入收集器,可利用FeCl3加热易升华的性质,在沉积的氯化铁固体下方加热,让氯化铁升华后进入收集器。答案为:在沉积的氯化铁固体下方加热;
(3)为防止FeCl3潮解,所采取的措施主要应从无水的角度考虑。从步骤中可找到如下操作:②通入干燥的Cl2,⑤用干燥的N2赶尽Cl2。答案为:②通入干燥的Cl2 ⑤用干燥的N2赶尽Cl2;
(4)装置B中冷水浴的作用为冷却FeCl3使其沉积,便于收集产品。答案为:冷却FeCl3使其沉积,便于收集产品;
装置C的名称为干燥管。答案为干燥管;
装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,检验FeCl2是否失效就是检验Fe2+,最好选用K3[Fe(CN)6]溶液,也可选用酸性高锰酸钾溶液。答案为:K3[Fe(CN)6]溶液,或酸性高锰酸钾溶液;
(5)在虚线框中尾气吸收装置E所用试剂为氢氧化钠溶液。答案为氢氧化钠溶液;
(6)步骤Ⅱ中,向滤液中加入过量KMnO4溶液的目的,将Fe2+全部氧化为 Fe3+;调节溶液的pH约为3的目的,将Fe3+全部转化为Fe(OH)3沉淀。答案为:将Fe2+全部氧化为 Fe3+,调节pH将Fe3+全部转化为沉淀。

【题目】X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大,有关信息如下表:
X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
Y | 地壳中含量位居第一位 |
Z | 短周期中,其原子半径最大 |
Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
请用对应元素的化学符号或化学式回答下列问题:
(1)X在周期表中的位置为_________;X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题.请写出该气态氢化物的电子式_________。
(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族。下列有关说法中正确的是________(填序号)。
a.原子半径:Rb>I
b.RbM中含有共价键
c.气态氢化物热稳定性:M>I
d.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
(3)化合物QX导热性好,热膨胀系数小,是良好的耐热冲击材料,其抗熔融金属侵蚀的能力强,是熔铸纯铁、铝或铝合金理想的坩埚材料。可用Q的氧化物、焦炭和X的单质在高温下生成QX,已知每生成1mol QX,消耗18g碳,吸收a kJ的热量。据此,写出以上制取QX的热化学方程式__________。
(4)X、Y组成的一种无色气体遇空气变为红棕色,将一定量该无色气体与氧气通入水中,恰好被完全吸收,生成一种酸,请写出该反应的化学方程式_______________。