题目内容
7.对可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )| A. | 达到化学平衡时,4v正(O2)=5v逆(NO) | |
| B. | 若单位时间内生成x mol NO的同时,消耗x molNH3,则反应达到平衡 | |
| C. | 达到化学平衡时,若增加容器体积,则正 反应速率减少,逆反应速率增加 | |
| D. | 化学反应速率关系是2v正(NH3)=3v正(H2O) |
分析 A、速率之比等于化学计量数之比;
B、都表示向反应正向进行,反应自始至终都是1:1,不能说明到达平衡;
C、若增加容器体积,反应物和生成物的浓度都减少;
D、速率之比等于对应物质的化学计量数之比.
解答 解:A、反应处于平衡状态时,不同物质表示正逆反应速率之比等于化学计量数之比,4v正(O2)=5v逆(NO),反应到达平衡状态,故A正确;
B、若单位时间内生成xmolNO的同时,消耗xmolNH3,都表示反应向正向进行,反应自始至终都是1:1,不能说明到达平衡,故B错误;
C、若增加容器体积,反应物和生成物的浓度都减少,正逆反应速率都减小,故C错误;
D、速率之比等于对应物质的化学计量数之比,所以化学反应速率关系是3v正(NH3=2v正(H2O),故D错误;
故选A.
点评 本题考查化学平衡状态的判断、平衡移动及影响平衡的因素等,题目难度中等,A选项中注意用不同物质的表示的正逆反应速率相等的表达方法,此为易错点.

练习册系列答案
相关题目
17.下列烷烃进行一氯代反应后,只生成3种沸点不同的产物的烷烃是( )
| A. | ( CH3)2CH( CH2)2 CH3 | B. | CH3 CH2 CH( CH3) CH2 CH3 | ||
| C. | ( CH3)2CHCH2CH( CH3)2 | D. | ( CH3)3 C CH2 CH3 |
2.我国是世界上严重缺碘的地区,全国有约四亿多人缺碘.为防止碘缺乏病,最方便有效的方法是食用含碘食盐,即在食盐中加入一定量的碘酸钾.下列有关食用碘盐的说法中,错误的是( )
| A. | 食用碘盐应避光保存 | |
| B. | 食用碘盐中碘元素以化合态形式存在 | |
| C. | 使用食用碘盐应避免高温煎炒 | |
| D. | 即使摄入过多的碘,对人体也无害 |
12.在t℃时,10L 0.4mol•L-1H2O2溶液发生催化分解:2H2O2═2H2O+O2↑,不同时刻测得生成O2的体积如下表,已知反应至6min时,H2O2分解了50%(已折算为标准状况)
下列叙述正确的是(溶液体积变化忽略不计)( )
| t/min | 0 | 2 | 4 | 6 |
| V(O2)/L | 0.0 | 9.9 | 17.2 | V=? |
| A. | 0~2min H2O2平均反应速率比4~6min慢 | |
| B. | 反应至6min时,共产生O244.8L | |
| C. | 0~6min的平均反应速率 v(H2O2)≈3.3×10-2mol•L-1•min-1 | |
| D. | 反应至6min时,c(H2O2)=0.3mol•L-1 |
16.能说明元素X的气态原子得电子能力比元素Y的气态原子得电子能力强的事实是( )
| A. | 元素周期表中X位于Y的上一周期 | |
| B. | X的含氧酸的酸性强于Y的含氧酸的酸性 | |
| C. | 将H2X、HY分别加热至500℃,只有HY发生分解 | |
| D. | X与Y同主族,相同温度时,二者的单质与铜反应分别生成Cu2X CuY |
17.常言“真金不怕火炼”从化学的角度对这句话的理解正确的是( )
| A. | 金的熔点高,难于融化 | |
| B. | 金的化学性质稳定,不易与其他物质反应 | |
| C. | 金越练越纯 | |
| D. | 金的硬度大,高温下难于变形 |
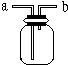 如图所示是中学化学实验中常见的装置,它有多种用途.
如图所示是中学化学实验中常见的装置,它有多种用途.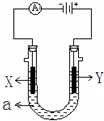 如图表示一个电解池,装有电解液a、X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a、X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: