题目内容
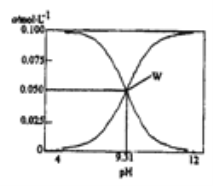
【题目】25℃,c(HCN)+c(CN-)=0.1mol/L的一组HCN和NaCN的混合溶液,溶液中c(HCN)、c(CN-)与pH的关系如图所示。下列有关离子浓度关系叙述正确的是
A. 将0.1mol/L的HCN溶液和0.1mol/LNaCN溶液等体积混合(忽略溶液体积变化): c(Na+)>c(HCN)>c(CN-)>c(OH-)>c(H+)
B. W点表示溶液中: c(Na+)+c(H+)=c(HCN)
C. pH=8的溶液中: c(Na+)+c(H+)+c(HCN)=0.1mol/L +c(OH-)
D. 将0.3mol/LHCN溶液和0.2mol/LNaOH溶液等体积混合(忽略溶液体积变化):c(CN-)+ 3c(OH-)=2c(HCN)+ 3c(H+)
【答案】CD
【解析】A,0.1mol/LHCN和0.1mol/LNaCN等体积的混合液呈碱性,CN-的水解程度大于HCN的电离程度,溶液中粒子浓度由大到小的顺序为:c(HCN)![]() c(Na+)
c(Na+)![]() c(CN-)
c(CN-)![]() c(OH-)
c(OH-)![]() c(H+),A项错误;B,HCN和NaCN的混合液中的物料守恒为:c(Na+)+c(H+)=c(CN-)+c(OH-),根据图像,W点c(HCN)=c(CN-)=0.05mol/L,则c(Na+)+c(H+)=c(HCN)+c(OH-),B项错误;C,根据电荷守恒:c(Na+)+c(H+)=c(CN-)+c(OH-),等式两边都加c(HCN)得c(Na+)+c(H+)+c(HCN)=c(CN-)+c(OH-)+c(HCN),c(HCN)+c(CN-)=0.1mol/L,则c(Na+)+c(H+)+c(HCN)=0.1mol/L+c(OH-),C项正确;D,0.3mol/LHCN溶液和0.2mol/LNaOH溶液等体积混合,溶液中电荷守恒为c(Na+)+c(H+)=c(CN-)+c(OH-),物料守恒为3c(Na+)=2[c(HCN)+c(CN-)],两式整理得c(CN-)+3c(OH-)=2c(HCN)+3c(H+),D项正确;答案选CD。
c(H+),A项错误;B,HCN和NaCN的混合液中的物料守恒为:c(Na+)+c(H+)=c(CN-)+c(OH-),根据图像,W点c(HCN)=c(CN-)=0.05mol/L,则c(Na+)+c(H+)=c(HCN)+c(OH-),B项错误;C,根据电荷守恒:c(Na+)+c(H+)=c(CN-)+c(OH-),等式两边都加c(HCN)得c(Na+)+c(H+)+c(HCN)=c(CN-)+c(OH-)+c(HCN),c(HCN)+c(CN-)=0.1mol/L,则c(Na+)+c(H+)+c(HCN)=0.1mol/L+c(OH-),C项正确;D,0.3mol/LHCN溶液和0.2mol/LNaOH溶液等体积混合,溶液中电荷守恒为c(Na+)+c(H+)=c(CN-)+c(OH-),物料守恒为3c(Na+)=2[c(HCN)+c(CN-)],两式整理得c(CN-)+3c(OH-)=2c(HCN)+3c(H+),D项正确;答案选CD。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案