��Ŀ����
����Ŀ��ij��ȤС��ͬѧ�������������ʵ����֤ij��ɫ��Һ�к��е����ӣ�
����Һ  ֱ�ӹ۲������Ե���ɫ���棺֤��û��K+
ֱ�ӹ۲������Ե���ɫ���棺֤��û��K+
����Һ ![]()
 ������ɫ������֤����SO42-
������ɫ������֤����SO42-
����Һ  ��ɫ����
��ɫ����  ��ɫ��Һ
��ɫ��Һ  ��ɫ������֤����Al3+����˵����ȷ���ǣ� ��
��ɫ������֤����Al3+����˵����ȷ���ǣ� ��
A.����ɫ��Һ�п�����������Һ
B.������ʵ���У���2���ͣ�3���������ܺ�����
C.����ܵ����ӷ���ʽΪ��Al3++3OH-=Al(OH)3��
D.����Ļ�ѧ����ʽ����Ϊ��NaAlO2+2H2O +CO2= Al(OH)3��+NaHCO3
���𰸡�D
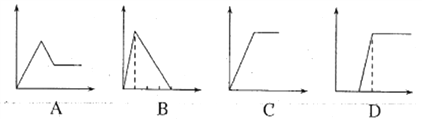
��������A��������ʮ��ˮ���������أ�ͨ��ʵ��1֪����Һ��û�м����ӣ����Բ�ѡA��B��ʵ��2��Ӧ���ȼ��������ữ���ټ����Ȼ��������ڵ�˳����������Ӹ��ţ����Բ����ܣ�ʵ��3�а�ɫ����Ϊ�������ʣ�ֻ�����������������������ƣ�����ʵ�����ܣ���ѡB��C�������Ϊ�����ӺͰ�ˮ��Ӧ��һˮ�ϰ���������ܲ��������ʽ�����Բ�ѡC��D�������Ϊƫ�����ƺͶ�����̼��Ӧ����������̼����ʱ������������������̼�����ƣ�����ѡD��

����Ŀ����Ҫ��ش�����
��1��KAl(SO4)2�ĵ��뷽��ʽ_______________________��
��2����ʯ����Һ��ͨ����������ʼʱ��Һ��죬һ��ʱ�����Һ��ɫ����ʹ��Һ������ɫ�����ֱ���______________��_________________ (��������)��
��3��ʵ��������������Ϊ36.5%���ܶ�Ϊ1.19g��cm-3��Ũ����������100ml��2mol/L��ϡ���ᣬ��Ҫ����Ͳ��ȡ_______________ml��Ũ���ᡣ
��4����ѧ����ʽH2S+H2SO4(Ũ)=SO2��+S��+2H2O��������4.48L(���) SO2ʱ��ת�Ƶĵ�����__________mol��
��5�������ĸ�ͼ���У��������ʾ�������ʵ����ʵ������������ʾ���ɳ�����������������������A��D��ѡ����ϸ���Ҫ���������˱��С�
��Һ | ��������� | ��� |
��AlCl3��Һ | ͨ�������NH3 | ___ |
��Na2CO3��NaOH����Һ | ������������� | ___ |
��NaAlO2��Һ | �μ�ϡ���������� | ___ |

