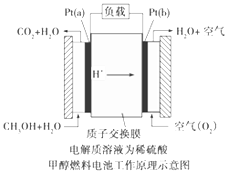
题目内容
【题目】下列实验操作不正确的是
A.蒸发食盐水制取氯化钠晶体时,要等水完全蒸干后再停止加热
B.用胶头滴管向试管中滴加液体时,不能伸入试管中滴加
C.稀释浓硫酸时,将浓硫酸沿烧杯内壁慢慢地加入水中,用玻璃棒不断搅拌
D.用托盘天平称量氢氧化钠固体时,可将氢氧化钠置于小烧杯中
【答案】A
【解析】
A、蒸发时不能直接蒸干,应当有大量固体析出时用余热蒸干,故A错误;B、用胶头滴管向试管中滴加液体时,应避免接触污染,故B正确;C、稀释浓硫酸时,应避免液体飞溅,可将浓硫酸沿烧杯内壁慢慢地加入水中,同时用玻璃棒不断搅拌,故C正确;D、氢氧化钠易潮解,称量时应尽量减小实验误差和防止腐蚀托盘,应将氢氧化钠置于小烧杯中,故D正确;故选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表是某“加碘食盐”包装袋上的部分文字说明.
配料 | 氯化钠(NaCl)、碘酸钾(KIO3) |
含碘量 | 20~40mgkg﹣1 |
保质期 | 18个月 |
食用方法 | 勿长时间炖炒 |
贮藏指南 | 避热、避光、密封、防潮 |
(1)经测定,该“加碘食盐”中KIO3的含量为42.8mgkg﹣1 . 计算每千克“加碘食盐”中KIO3的物质的量为多少?该“加碘食盐”的含碘量为多少?.
(2)将5.0g该“加碘食盐”溶于水中配成100mL溶液,该溶液中IO ![]() 离子物质的量浓度为多少?
离子物质的量浓度为多少?
【题目】研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:
(1)生产水煤气过程中有以下反应: ①C(s)+CO2(g)2CO(g)△H1;
②CO(g)+H2O(g)H2(g)+CO2(g)△H2;
③C(s)+H2O(g)CO(g)+H2(g)△H3;
若平衡表达式为K= ![]() ,则它所对应的化学反应方程式是(填序号) .
,则它所对应的化学反应方程式是(填序号) .
(2)对反应①下列说法中能说明该反应达到平衡状态的 a.温度和体积一定时,混合气体的颜色不再变化
b.温度和体积一定时,容器内的压强不再变化
c.温度和体积一定时,生成物的浓度不再变化
d.温度和体积一定时,混合气体的密度不再变化
(3)不同温度下反应②的平衡常数如下表所示.则△H20(填“<”或“>”);在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005molL﹣1、c(H2)=0.015molL﹣1 , 则CO的平衡转化率为 .
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.945795506 | 9 | 1 |
(4)对反应2NO2(g)N2O4(g)△H<0在温度为T1、T2时,平衡体系N2O4的体积分数随压强变化曲线如图所示. 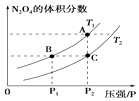
则T1T2(填“>”或“<”);增大压强,平衡移动(填“正反应方向”或“逆反应方向”或“不”);B、C两点的平衡常数BC(填“>”或“<”).