��Ŀ����
����Ŀ��Ϊ�˲ⶨһ����������������������ͼ��ʾ��װ�ú�����ʵ��ҩƷ����һ����пƬ��������ϡ�������Թ�A�з�Ӧ��������B���ɼס���������������ɣ���������Ƥ����ͨ����װ����ˮ�����п̶ȣ��ס��ҹܿɹ̶�������̨�ϣ��������ã��ҹܿ������ƶ����Ե���Һ��ߵ͡��ش��������⣺
(1)д��п��ϡ���ᷴӦ�Ļ�ѧ����ʽ��__________________________________��
(2)��֪����������H2���ܶ�Ϊ0.087 0 g��L��1������ܵĿ̶����ֵ��100 mL����ʵ���г�ȡпƬ�����������__________g��
(3)Ϊ��ȷ�ز���H2��������ڶ�ȡ��Ӧ�����Һ��Ķ���ʱ��Ӧע��________(��д���)��
A�������밼Һ����ʹ���ƽ
B���ȴ�Ƭ�̣����ҹ�Һ�治������ʱ����
C������ʱӦ�ϡ����ƶ��ҹܣ�ʹ�ס�������Һ����ƽ
D��������һ��ʹ�ס�������Һ����ƽ
���𰸡�Zn��H2SO4===ZnSO4��H2�� 0.283 ABC
��������
(1)п��ϡ���ᷴӦ��������п��������
(2)���÷���ʽ���㣻
(3)Ϊ�˽�ȷ�ز���������������ٶ���ʱҪ���ڼס��ҵ�Һ��ʹ��ͬһ�߶ȣ��ڶ���ʱ����Ҫ�밼Һ����ʹ���ƽ�����¶Ȼָ������£����ҹ�Һ�治������������
(1)п��ϡ���ᷴӦ��������п����������Ӧ����ʽΪZn��H2SO4===ZnSO4��H2����
(2)��п���������Ϊxg��

�з��̣�����x��0.283 g��
(3)Ϊ�˽�ȷ�ز�����������������˱���������װ�õ�������֮�⣬����ʱӦע�⣺�ٶ���ʱҪ���ڼס��ҵ�Һ��ʹ��ͬһ�߶ȣ��Ա�֤�����ѹ�������������ڶ���ʱ����Ҫ�밼Һ����ʹ���ƽ���۴��ҹ�Һ�治������ʱ��Ҳ�����¶Ȼָ������£��Զ�������������������������ȷѡ��ΪABC��

 ��ǰ�κ�ͬ����ϰϵ�д�
��ǰ�κ�ͬ����ϰϵ�д� ����С��ҵϵ�д�
����С��ҵϵ�д� �Ƹ�С״Ԫ����������ϰ��ϵ�д�
�Ƹ�С״Ԫ����������ϰ��ϵ�д� �ɹ�ѵ���ƻ�ϵ�д�
�ɹ�ѵ���ƻ�ϵ�д� ����ѵ����ֱͨ�п�����ϵ�д�
����ѵ����ֱͨ�п�����ϵ�д�����Ŀ�������£���һ��Ũ�ȵ�һԪ��HA��Һ��һ��Ũ�ȵ�NaOH��Һ�������ϣ���������仯����ʵ���������±���
ʵ���� | ��ʼŨ�ȣ�mol/L�� | ��Ӧ����Һ��pH | |
|
| ||
�� | 0.1 | 0.1 | 9 |
�� |
| 0.2 | 7 |
�����жϲ���ȷ���ǣ� ��
A.ʵ��ٷ�Ӧ����Һ�У�![]()
B.ʵ��ٷ�Ӧ����Һ�У�![]()
C.ʵ��ڷ�Ӧ����Һ�У�![]()
D.ʵ��ڷ�Ӧ����Һ�У�![]()
����Ŀ����֪��ѧ��Ӧ��:Fe(s)+CO2(g)![]() FeO(s)+CO(g),�仯ѧƽ�ⳣ��ΪK1;��ѧ��Ӧ��:Fe(s)+H2O(g)
FeO(s)+CO(g),�仯ѧƽ�ⳣ��ΪK1;��ѧ��Ӧ��:Fe(s)+H2O(g)![]() FeO(s)+H2(g),�仯ѧƽ�ⳣ��ΪK2,���¶�973 K��1173 K�������,K1��K2��ֵ�ֱ�����:
FeO(s)+H2(g),�仯ѧƽ�ⳣ��ΪK2,���¶�973 K��1173 K�������,K1��K2��ֵ�ֱ�����:
�¶� | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)ͨ�������е���ֵ�����ƶ�:��Ӧ����_______(��������������������)��Ӧ��
(2)���з�Ӧ��:CO2(g)+H2(g)![]() CO(g)+H2O(g),����д���÷�Ӧ��ƽ�ⳣ��K3�ı���ʽ:K3=______��
CO(g)+H2O(g),����д���÷�Ӧ��ƽ�ⳣ��K3�ı���ʽ:K3=______��
(3)���ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵʽΪ__________,�ݴ˹�ϵʽ���ϱ�����,���ƶϳ���Ӧ����________(��������������������)��Ӧ��
(4)Ҫʹ��Ӧ����һ�������½�����ƽ��������Ӧ�����ƶ�,�ɲ�ȡ�Ĵ�ʩ��______ ��_____ (��д��ĸ���)��
A.��С��Ӧ�������ݻ� B.����Ӧ�������ݻ�
C.�����¶� D.ʹ�ú��ʵĴ���
E.�跨��Сƽ����ϵ�е�CO��Ũ��
(5)ͼ�ס��ҷֱ��ʾ��Ӧ����t1ʱ�̴ﵽƽ��,��t2ʱ����ı�ij�������������仯�����:
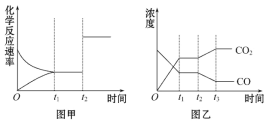
��ͼ����t2ʱ�̷����ı��������__________��
��ͼ����t2ʱ�̷����ı��������__________��


