题目内容
11.下列物质中,与0.3mol H2O含有相同氢原子数的物质是( )| A. | 18.9g HNO3 | B. | 3.612×1023个HCl分子 | ||
| C. | 0.1molH3PO4 | D. | 4.48L CH4(标准状况) |
分析 0.3mol H2O含有氢原子物质的量为0.3mol×2=0.6mol,由N=nNA可知,H原子个数相同,则H原子的物质的量相等,根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$计算硝酸、HCl、甲烷的物质的量,结合每个分子含有H原子数目计算含有H原子物质的量.
解答 解:0.3mol H2O含有氢原子物质的量为0.3mol×2=0.6mol,
A.18.9 g HNO3物质的量为$\frac{18.9g}{63/mol}$=0.3mol,由于每个硝酸分子含有1个H原子,故含有H原子物质的量为0.3mol×1=0.3mol,故A不符合;
B.HCl物质的量为$\frac{3.612×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.6mol,由于每个HCl分子含有1个H原子,故含有H原子物质的量为0.6mol×1=0.6mol,故B符合;
C.由于每个H3PO4分子含有3个H原子,故含有H原子物质的量为0.1mol×3=0.3mol,故C不符合;
D.CH4物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,由于每个CH4分子含有4个H原子,故含有H原子物质的量是0.2mol×4=0.8mol,故D不符合,
故选:B.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心的有关计算.

练习册系列答案
相关题目
1.在一定温度下,某浓度的硝酸与金属锌反应生成N02和NO,两者的物质的量之比为1:3,则要使1mol金属锌完全反应,反应过程中消耗此硝酸的物质的量为( )
| A. | 2.4 mol | B. | 2.6 mol | C. | 2.8mol | D. | 3.2 mol |
6.下列说法中不正确的是( )
| A. | 体积相同、c(Na+)相等的纯碱溶液与小苏打溶液,分别与足量同种盐酸反应,消耗盐酸的体积相等 | |
| B. | 将铜粉加入氯化铁溶液,充分反应后,若固体有剩余,则该固体不可能含铁 | |
| C. | 用AlCl3溶液制取Al(OH)3,沉淀剂选用氨水比选用NaOH溶液好 | |
| D. | 相同质量的钠、镁、铝分别与足量的稀硫酸反应,生成气体的质量之比为27:24:23 |
16.下列说法错误的是( )
| A. | 电解饱和食盐水可制取烧碱、氯气、氢气 | |
| B. | 粗铜(含少量Zn、Fe、Pt等)电解精炼后,溶液中金属阳离子只有Fe2+、Zn2+ | |
| C. | 以海水为原料可提取镁、溴、碘等物质 | |
| D. | 在镀件上镀铜,镀件作阴极 |
3.将H2、O2、Cl2三种气体,按质量比为18:128:71混合,盛在密闭容器中用电火花引爆(H2+Cl2=2H Cl),充分反应后经冷却、液化,所得溶液中溶质的质量分数为( )
| A. | 37% | B. | 33.6% | C. | 18.5% | D. | 16.8% |
20.有关如图及实验的描述正确的是( )
| A. |  用图装置蒸发FeCl3溶液制备无水FeCl3 用图装置蒸发FeCl3溶液制备无水FeCl3 | |
| B. |  用图装置电解精炼铝 用图装置电解精炼铝 | |
| C. | 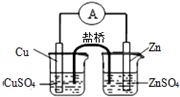 用图装置构成铜锌原电池 用图装置构成铜锌原电池 | |
| D. |  用图装置定量测定化学反应速率 用图装置定量测定化学反应速率 |
1. 甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是:
甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是:
CH4(g)+H2O(g)=CO(g)+3H2(g)
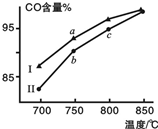
其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下反应相同时间后,体系中CO含量随反应温度的变化如图所示.下列说法正确的是( )
 甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是:
甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是:CH4(g)+H2O(g)=CO(g)+3H2(g)
其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下反应相同时间后,体系中CO含量随反应温度的变化如图所示.下列说法正确的是( )
| A. | 相同条件下,催化剂Ⅱ催化效率更高 | |
| B. | b点表示上述反应在对应条件下的平衡状态 | |
| C. | 根据图象,无法判断该反应是否为吸热反应 | |
| D. | 该反应平衡常数表达式为K=$\frac{c(CO)•c3(H2)}{c(CH4)}$ |