题目内容
为除去粗盐中的Ca2+、Mg2+、SO 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
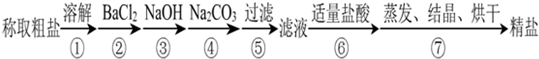
(1)在第①步和第⑤步中都需要用到玻璃棒,其作用分别是______、______.
(2)判断BaCl2已过量的方法是______.
(3)第④步中,相关的离子方程式是______.
(4)若先用盐酸再过滤,将对实验结果产生影响,其原因是______.
解:(1)在第①步和第⑤步中都需要用到玻璃棒,①步是用玻璃棒搅拌加快固体溶解;⑤是过滤操作,在过滤中玻璃棒起到引流作用,故答案为:搅拌,加快溶解;引流;
(2)加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽,BaCl2溶液已过量,
故答案为:取少量②中上层清液于试管中,向其中滴加BaCl2溶液,若无沉淀产生,则BaCl2溶液已过量;
(3)第④步是利用碳酸钠除去钙离子和过量的钡离子,反应的离子方程式为:Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓;故答案为:Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓;
(4)若先加适量盐酸再过滤,生成的沉淀如CaCO3、Mg(OH)2、BaCO3会溶解在盐酸中,影响制得精盐的纯度;
故答案:会有部分沉淀如CaCO3、Mg(OH)2、BaCO3溶解,离子重新进入溶液,从而影响制得精盐的纯度.
分析:(1)溶解是搅拌,加快溶解;过滤是引流作用;
(2)加入氯化钡溶液检验硫酸根离子是否除尽,来判断氯化钡是否过量;
(3)第④步是利用碳酸钠除去钙离子和过量的钡离子;
(4)若先加适量盐酸再过滤,生成的碳酸钙、碳酸钡沉淀会溶解于盐酸达不到提纯氯化钠的作用.
点评:本题考查了粗盐提纯的实验方法、注意问题、离子性质的应用,关键是除杂试剂的加入顺序判断,需要过量的试剂最后易于除去,题目难度中等.
(2)加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽,BaCl2溶液已过量,
故答案为:取少量②中上层清液于试管中,向其中滴加BaCl2溶液,若无沉淀产生,则BaCl2溶液已过量;
(3)第④步是利用碳酸钠除去钙离子和过量的钡离子,反应的离子方程式为:Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓;故答案为:Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓;
(4)若先加适量盐酸再过滤,生成的沉淀如CaCO3、Mg(OH)2、BaCO3会溶解在盐酸中,影响制得精盐的纯度;
故答案:会有部分沉淀如CaCO3、Mg(OH)2、BaCO3溶解,离子重新进入溶液,从而影响制得精盐的纯度.
分析:(1)溶解是搅拌,加快溶解;过滤是引流作用;
(2)加入氯化钡溶液检验硫酸根离子是否除尽,来判断氯化钡是否过量;
(3)第④步是利用碳酸钠除去钙离子和过量的钡离子;
(4)若先加适量盐酸再过滤,生成的碳酸钙、碳酸钡沉淀会溶解于盐酸达不到提纯氯化钠的作用.
点评:本题考查了粗盐提纯的实验方法、注意问题、离子性质的应用,关键是除杂试剂的加入顺序判断,需要过量的试剂最后易于除去,题目难度中等.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目


 为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):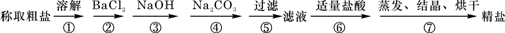

 aOH溶液 b、KOH溶液 c、BaCl2溶液 d、Ba(NO3)2溶液
aOH溶液 b、KOH溶液 c、BaCl2溶液 d、Ba(NO3)2溶液