题目内容
下列叙述正确的是( )?
A共价键只存在于共价化合物分子中
B离子键只存在于离子化合物中?
C含有极性键的分子一定是极性分子
D极性分子中一定含有极性键?
A共价键只存在于共价化合物分子中
B离子键只存在于离子化合物中?
C含有极性键的分子一定是极性分子
D极性分子中一定含有极性键?
BD
本题主要考查对化合物类型化学键的关系。共价键除了存在于共价化合物中外,还可以存在于某些单质(如Cl2、O2等多原子分子,金刚石、石墨等单质晶体)及含有原子团的离子化合物中(如NH4Cl、Na2SO4);而化合物只要含有离子键,就一定属于离子化合物;含有极性键的分子,如果其分子结构是对称的,分子内电荷的分布是均匀的,正负电荷重心重合,则整个分子就没有极性,这样的分子有很多,如直线型的CO2,平面三角形的BF3、SO3,正四面体的CH4、CCl4等;而极性分子中,正负电荷的重心一定是不重合的,说明其中一定含有极性的共价键。?

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
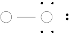 ( )
( ) ( ) (4)
( ) (4)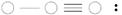 ( )
( )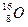 和
和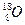 ,它们可分别形成16On和18Om两种气体单质。请完成下列问题:
,它们可分别形成16On和18Om两种气体单质。请完成下列问题: