题目内容
【题目】亚硝酸氯(ClNO)是有机合成中的重要试剂。亚硝酸氯可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) ΔH1
2NaNO3(s)+2NO(g)+Cl2(g) ΔH1
②2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) ΔH2
NaNO3(s)+ClNO(g) ΔH2
③2NO(g)+Cl2(g)![]() 2ClNO(g) ΔH3
2ClNO(g) ΔH3
则ΔH1、ΔH2、ΔH3之间的关系为ΔH3=____________。
(2)已知几种化学键的键能数据如表(亚硝酸氯的结构为Cl-N=O,一氧化氮的结构为N≡O)
化学键 | N≡O | Cl-Cl | Cl-N | N=O |
键能/kJ mol-1 | 630 | 243 | a | 607 |
则2NO(g)+Cl2(g)![]() 2ClNO(g)反应的ΔH=_________kJ ·mol-1
2ClNO(g)反应的ΔH=_________kJ ·mol-1
(3)T℃时,2NO(g)+Cl2(g) ![]() 2ClNO(g)的正反应速率表达式为υ正=kcn(ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为υ正=kcn(ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/mol·L-1 | υ/mol·L-1· s-1 |
① | 0.30 | 3.6×10-8 |
② | 0.60 | 1.44×10-7 |
③ | 0.90 | 3.24×10-7 |
n=__________;k=___________(注明单位)。
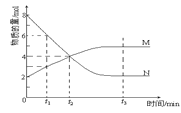
(4)在2 L的恒容密闭容器中充入4mol NO(g)和2molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图。
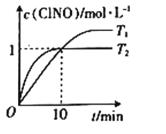
①由图可知T1、T2温度的速率υ1______υ2温度T1______T2。(填>、<或=)
②温度为T1时,能作为该反应达到平衡的标志的有__________。
a.气体体积保持不变 b.容器压强保持不变 c.气体颜色保持不变 d.υ(ClNO)=υ(NO) e.NO与ClNO的物质的量比值保持不变
③反应开始到10min时,Cl2的平均反应速率υ(Cl2)=_______________。
【答案】2ΔH2-ΔH1 289-2a 2 4×10-7L·mol-1·s-1 < < bce 0.05mol·L-1·min-1
【解析】
(1)根据盖斯定律,将方程式2×②-①得方程式③,则ΔH3=2ΔH2-ΔH1,本题答案为:2ΔH2-ΔH1;
(2)反应的焓变ΔH等于反应物总键能减去生成物总键能,即有ΔH=(630×2+243-607×2-2a)kJ ·mol-1=(289-2a)kJ ·mol-1,本题答案为:289-2a;
(3)根据表格信息计算可得,反应速率与ClNO浓度的平方成正比,所以n=2,将n=2代入υ正=kcn(ClNO),并将表中数据代入该式,计算可得k=4×10-7L·mol-1·s-1,本题答案为:2;4×10-7L·mol-1·s-1;
(4)①由图可知T1<T2,温度越高,速率越快,所以的速率υ<υ2,故本题答案为:<;<;
②a.恒容条件下,容器体积始终保持不变,不能据此判断平衡状态,故错误;
b.反应前后气体的物质的量减小,压强越小,当容器压强保持不变时,正逆反应速率相等,反应达到平衡状态,故正确;
c.只有氯气有颜色,当气体颜色保持不变,正逆反应速率相等,反应达到平衡状态,故正确;
d.υ(ClNO)=υ(NO) 时反应方向未知,无法确定是否达到平衡状态,故错误;
e.NO与ClNO的物质的量比值保持不变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选bce;
③反应开始到10min时,同一时间段内各物质的反应速率之比等于其计量数之比,据此得
![]() ,故本题答案为:
,故本题答案为:![]() 。
。