题目内容
【题目】请结合下图回答问题: 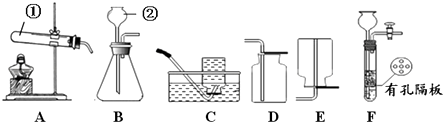
(1)写出有标号的仪器名称:① , ② .
(2)实验室用高锰酸钾制取O2的化学方程式为 , 用A、C装置制取O2时,为防止高锰酸钾进入导管,可采取的措施是 .
(3)实验室用B、D装置制取CO2的化学方程式为 , 若将发生装置由B改为F,其优点是 .
(4)SO2是无色有刺激性气味的有毒气体,密度比空气大,易溶于水.SO2的某些化学性质与CO2相似,实验中常用NaOH溶液吸收SO2尾气.用下图所示装置收集一瓶干燥的SO2 , 装置中导管按气流方向连接顺序是→⑤(填序号);图中漏斗的作用是;烧杯中NaOH溶液的作用是(用化学方程式表示). 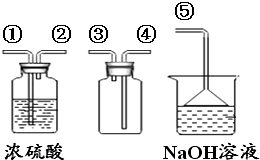
【答案】
(1)试管;长颈漏斗
(2)2KMnO4 ![]() K2MnO4+MnO2+O2↑;在试管口放一小团棉花
K2MnO4+MnO2+O2↑;在试管口放一小团棉花
(3)CaCO3+2HCl=CaCl2+H2O+CO2↑;可随时控制反应的发生和停止
(4)①→②→④→③;防止倒吸现象;2NaOH+SO2=Na2SO3+H2O
【解析】解:(1)由图可知,仪器①为试管,②为长颈漏斗,所以答案是:试管;长颈漏斗;(2)高锰酸钾制取O2 , 加热高锰酸钾分解生成氧气、锰酸钾、二氧化锰,反应方程式为2KMnO4 ![]() K2MnO4+MnO2+O2↑;用A、C装置制取O2时,为防止高锰酸钾进入导管,可在试管口放一小团棉花,保证粉末不能堵塞导管,所以答案是:2KMnO4
K2MnO4+MnO2+O2↑;用A、C装置制取O2时,为防止高锰酸钾进入导管,可在试管口放一小团棉花,保证粉末不能堵塞导管,所以答案是:2KMnO4 ![]() K2MnO4+MnO2+O2↑;在试管口放一小团棉花;(3)用B、D装置制取CO2 , 为固体、液体反应不加热装置,利用碳酸钙与盐酸反应即可,反应方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;将发生装置由B改为F,F中有分液漏斗,其优点是可随时控制反应的发生和停止,所以答案是:CaCO3+2HCl=CaCl2+H2O+CO2↑;可随时控制反应的发生和停止;(4)图示装置收集一瓶干燥的SO2 , 先干燥气体、再收集,最后尾气处理,则装置中导管按气流方向连接顺序是①→②→④→③→⑤;图中漏斗的作用是可防止倒吸现象,烧杯中NaOH吸收二氧化硫,防止二氧化硫污染环境,反应为2NaOH+SO2=Na2SO3+H2O, 所以答案是:①→②→④→③;防止倒吸现象;2NaOH+SO2=Na2SO3+H2O.
K2MnO4+MnO2+O2↑;在试管口放一小团棉花;(3)用B、D装置制取CO2 , 为固体、液体反应不加热装置,利用碳酸钙与盐酸反应即可,反应方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;将发生装置由B改为F,F中有分液漏斗,其优点是可随时控制反应的发生和停止,所以答案是:CaCO3+2HCl=CaCl2+H2O+CO2↑;可随时控制反应的发生和停止;(4)图示装置收集一瓶干燥的SO2 , 先干燥气体、再收集,最后尾气处理,则装置中导管按气流方向连接顺序是①→②→④→③→⑤;图中漏斗的作用是可防止倒吸现象,烧杯中NaOH吸收二氧化硫,防止二氧化硫污染环境,反应为2NaOH+SO2=Na2SO3+H2O, 所以答案是:①→②→④→③;防止倒吸现象;2NaOH+SO2=Na2SO3+H2O.

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案