��Ŀ����
����Ŀ�������������в����ķ�ˮ�������ǻ�����Ⱦ����ҪԴͷ���ڻ��������������ǿ�����I2O5��Na2SO3�Ȼ�����Ʒʵ�ֶԷ�ˮ�ͷ�����������
��1������I2O5�������Դ�������H2S���õ�S��I2���ֵ��ʣ�������Ӧ�Ļ�ѧ����ʽΪ________________��
��2������I2O5Ҳ������CO����Ⱦ���䷴Ӧԭ��ΪI2O5(s)+5CO(g)![]() 5CO2(g)+I2(s) ��H����֪�ڲ�ͬ�¶ȣ�T1��T2���£���װ������I2O5�����2 L�����ܱ�������ͨ��2 mol CO�����CO2��������������(CO2)��ʱ��t�ı仯������ͼ��ʾ��
5CO2(g)+I2(s) ��H����֪�ڲ�ͬ�¶ȣ�T1��T2���£���װ������I2O5�����2 L�����ܱ�������ͨ��2 mol CO�����CO2��������������(CO2)��ʱ��t�ı仯������ͼ��ʾ��
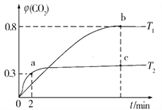
���¶�ΪT2ʱ��0��2 min �ڣ�CO2��ƽ����Ӧ���� ��(CO2)=______________��
��b��ʱCO��ת����Ϊ_______����ѧ��Ӧ��ƽ�ⳣ��K=_____�������ʽ����
�۷�Ӧ��I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s)����H______0������>����<������=������
5CO2(g)+I2(s)����H______0������>����<������=������
��������Ӧ��T1�´ﵽƽ��ʱ�����������г������ʵ�����Ϊ2 mol��CO��CO2���壬��ѧƽ��________������������ �������������������ƶ���
�����������Ա�ʾ������Ӧ�ﵽƽ��״̬����____________������ĸ����
A�������ڵ�ѹǿ���ٱ仯 B���������ƽ����Է����������ٱ仯
C����������ܶȲ��ٱ仯 D����λʱ��������CO������CO2�����ʵ���֮��Ϊ1��1
��3��Na2SO3���л�ԭ�ԣ���ˮ��Һ��������Cl2(g)�����ٻ�����Ⱦ��
��֪��Ӧ��
��Na2SO3(aq)+Cl2(g)+H2O(l) ![]() Na2SO4(aq)+2HCl(aq) ��H1=a kJ��mol1
Na2SO4(aq)+2HCl(aq) ��H1=a kJ��mol1
��Cl2(g)+H2O(l) ![]() HCl(aq)+HClO(aq) ��H2=b kJ��mol1
HCl(aq)+HClO(aq) ��H2=b kJ��mol1
��д��Na2SO3(aq)��HClO(aq)��Ӧ���Ȼ�ѧ����ʽ��________________________��
���𰸡� I2O5 + 5 H2S = 5S + I2 + 5H2O 0.15 mol��L-1 ��min-1 80% C5(CO2)/ C5(CO) < ���� BC Na2SO3(aq) + HClO(aq) ![]() Na2SO4(aq) + 2HCl(aq) ��H=��a-b��kJ��mol1
Na2SO4(aq) + 2HCl(aq) ��H=��a-b��kJ��mol1
����������1������I2O5�������Դ�������H2S��H2S������ΪS��I2O5����ԭΪI2�����ݻ��ϼ�������������Լ������غ㶨�ɣ�����д���÷�Ӧ�Ļ�ѧ����ʽΪI2O5 + 5 H2S = 5S + I2 + 5H2O��
��2���÷�Ӧ��һ��������������ֲ���ķ�Ӧ�����Է�Ӧǰ����������ʵ������ֲ��䡣��ͼ���֪����Ӧ��T2ʱ�ȴﵽƽ��״̬������T1<T2���¶�T1�����ߵ�T2����(CO2)��С��˵������Ӧ�Ƿ��ȷ�Ӧ��
���¶�ΪT2ʱ��0��2 min �ڣ���(CO2)��0���ߵ�0.3����CO2�ı仯��Ϊ2mol![]() ��CO2��ƽ����Ӧ������(CO2)=
��CO2��ƽ����Ӧ������(CO2)= ![]() 0.15 mol��L-1 ��min-1��
0.15 mol��L-1 ��min-1��
��b��ʱ��(CO2)=0.8��CO�ı仯��Ϊ0.8![]() ��CO��ת����Ϊ
��CO��ת����Ϊ![]() 80% ������������͵ⶼ�ǹ��壬���Ըû�ѧ��Ӧ��ƽ�ⳣ��K= C5(CO2)/ C5(CO)��
80% ������������͵ⶼ�ǹ��壬���Ըû�ѧ��Ӧ��ƽ�ⳣ��K= C5(CO2)/ C5(CO)��
�۷�Ӧ��I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s)����H<0��
5CO2(g)+I2(s)����H<0��
��������Ӧ��T1�´ﵽƽ��ʱ��c(CO)=0.2mol/L��c(CO2)=0.8mol/L��K= C5(CO2)/ C5(CO)= ![]() �����������г������ʵ�����Ϊ2 mol��CO��CO2���壬Qc=
�����������г������ʵ�����Ϊ2 mol��CO��CO2���壬Qc=![]() <K����ѧƽ�������ƶ���
<K����ѧƽ�������ƶ���
����Ϊ��Ӧǰ��������������䣬���������ڵ�ѹǿ�������仯��CO��CO2�Ļ�ѧ����������ͬ�ģ����Ե�λʱ��������CO������CO2�����ʵ���֮��ʼ��Ϊ1��1��ʼ�ղ�������ݲ�����Ϊƽ��״̬�ı�־���������ƽ����Է��������ͻ�������ܶ��DZ��������Կ��Ա�ʾ������Ӧ�ﵽƽ��״̬���ǻ������ƽ����Է����������ٱ仯�ͻ�������ܶȲ��ٱ仯����BC��
��3����Na2SO3(aq)+Cl2(g)+H2O(l) ![]() Na2SO4(aq)+2HCl(aq) ��H1=a kJ��mol1����Cl2(g)+H2O(l)
Na2SO4(aq)+2HCl(aq) ��H1=a kJ��mol1����Cl2(g)+H2O(l) ![]() HCl(aq)+HClO(aq) ��H2=b kJ��mol1������-�ڵ���Na2SO3(aq) + HClO(aq)
HCl(aq)+HClO(aq) ��H2=b kJ��mol1������-�ڵ���Na2SO3(aq) + HClO(aq) ![]() Na2SO4(aq)+ 2HCl(aq)��������H=��a-b��kJ��mol1����Na2SO3(aq)��HClO(aq)��Ӧ���Ȼ�ѧ����ʽΪNa2SO3(aq) + HClO(aq)
Na2SO4(aq)+ 2HCl(aq)��������H=��a-b��kJ��mol1����Na2SO3(aq)��HClO(aq)��Ӧ���Ȼ�ѧ����ʽΪNa2SO3(aq) + HClO(aq) ![]() Na2SO4(aq) + 2HCl(aq) ��H=��a-b��kJ��mol1��
Na2SO4(aq) + 2HCl(aq) ��H=��a-b��kJ��mol1��

 �ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
�ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�����Ŀ��ij�¶��£�H2��g�� + CO2��g�� ![]() H2O��g��+ CO��g����ƽ�ⳣ��K=9/4�����¶��£��ڼס��ҡ������������ܱ������У�Ͷ��H2��g���� CO2��g��������ʼŨ�����±���ʾ
H2O��g��+ CO��g����ƽ�ⳣ��K=9/4�����¶��£��ڼס��ҡ������������ܱ������У�Ͷ��H2��g���� CO2��g��������ʼŨ�����±���ʾ
��ʼŨ�� | �� | �� | �� |
C��H2��/ mol��l-1 | 0.010 | 0.020 | 0.020 |
C��CO2��/ mol��l-1 | 0.010 | 0.010 | 0.020 |
�����жϲ���ȷ����
A. ƽ��ʱ������CO2 ��ת���ʴ���60%
B. ƽ��ʱ���ͱ���H2 ��ת���ʾ���60%
C. ƽ��ʱ������C��CO2���Ǽ��е�2������0.012 mol��l-1
D. ��Ӧ��ʼʱ�����еķ�Ӧ������죬���еķ�Ӧ��������