题目内容
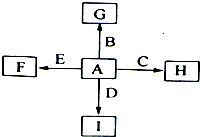
几种中学化学常见的单质及其化合物相互转化的关系图如下:
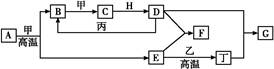
可供参考的信息有:
①甲、乙、丙、丁为单质,其余为化合物。A、E、F、G四种物质中含同种元素。
②A由X和Y两种元素组成,其原子个数比为1∶2,元素质量之比为7∶8。
③B气体是引起酸雨的主要物质,H常温下为无色无味的液体,E常用作红色油漆和涂料。
试根据上述信息回答下列问题:
(1)A的化学式为 ,每反应1 mol的A转移的电子为 mol;
(2)F与丁单质也可以化合生成G,试写出该反应的离子方程式: ;
(3)少量F的饱和溶液分别滴加到下列物质中,得到三种分散系①、②、③。
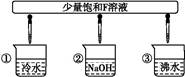
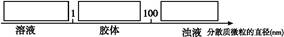
试将①、②、③三个序号以及对应的分散质具体的化学式填入下列方框中:
(4)化合物M与H组成元素相同,可以将G氧化为F,且不引进新的离子。试写出M在酸性环境下将G氧化为F的离子方程式: 。

可供参考的信息有:
①甲、乙、丙、丁为单质,其余为化合物。A、E、F、G四种物质中含同种元素。
②A由X和Y两种元素组成,其原子个数比为1∶2,元素质量之比为7∶8。
③B气体是引起酸雨的主要物质,H常温下为无色无味的液体,E常用作红色油漆和涂料。
试根据上述信息回答下列问题:
(1)A的化学式为 ,每反应1 mol的A转移的电子为 mol;
(2)F与丁单质也可以化合生成G,试写出该反应的离子方程式: ;
(3)少量F的饱和溶液分别滴加到下列物质中,得到三种分散系①、②、③。

试将①、②、③三个序号以及对应的分散质具体的化学式填入下列方框中:

(4)化合物M与H组成元素相同,可以将G氧化为F,且不引进新的离子。试写出M在酸性环境下将G氧化为F的离子方程式: 。
(1)FeS2 11
(2)2Fe3++Fe 3Fe2+
3Fe2+
(3)①Fe2(SO4)3③Fe(OH)3②Fe(OH)3
(4)H2O2+2H++2Fe2+ 2H2O+2Fe3+
2H2O+2Fe3+
(2)2Fe3++Fe
 3Fe2+
3Fe2+(3)①Fe2(SO4)3③Fe(OH)3②Fe(OH)3
(4)H2O2+2H++2Fe2+
 2H2O+2Fe3+
2H2O+2Fe3+由③中信息:B气体是引起酸雨的主要物质,则B为SO2;H常温下为无色无味的液体,则H为H2O;E常用作红色油漆和涂料,故E为Fe2O3,则A中应含Fe、S两种元素。由②可计算得到A的化学式为FeS2。再结合流程图可推知甲为O2,C为SO3,D为H2SO4。由E(Fe2O3) 丁(单质)可知,丁为Fe,D(H2SO4)+E(Fe2O3)
丁(单质)可知,丁为Fe,D(H2SO4)+E(Fe2O3) F,则F为Fe2(SO4)3。(1)FeS2高温下燃烧的化学方程式为:4FeS2+11O2
F,则F为Fe2(SO4)3。(1)FeS2高温下燃烧的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2,由此分析可知,每消耗4 mol FeS2,转移电子为44 mol,即每反应1 mol的A(FeS2)转移的电子为11 mol;(2)由转化关系图可知F为Fe2(SO4)3,丁为Fe,G为FeSO4,则有关的离子反应为Fe+2Fe3+
2Fe2O3+8SO2,由此分析可知,每消耗4 mol FeS2,转移电子为44 mol,即每反应1 mol的A(FeS2)转移的电子为11 mol;(2)由转化关系图可知F为Fe2(SO4)3,丁为Fe,G为FeSO4,则有关的离子反应为Fe+2Fe3+ 3Fe2+;(3)将少量饱和Fe2(SO4)3溶液加入①冷水中形成溶液;加入②NaOH溶液中会产生Fe(OH)3沉淀,形成浊液;加入③沸水中会产生Fe(OH)3胶体;(4)化合物M与H(H2O)组成元素相同,则M为H2O2,M在酸性条件下将G(FeSO4)氧化为F[Fe2(SO4)3]的离子方程式为:H2O2+2H++2Fe2+
3Fe2+;(3)将少量饱和Fe2(SO4)3溶液加入①冷水中形成溶液;加入②NaOH溶液中会产生Fe(OH)3沉淀,形成浊液;加入③沸水中会产生Fe(OH)3胶体;(4)化合物M与H(H2O)组成元素相同,则M为H2O2,M在酸性条件下将G(FeSO4)氧化为F[Fe2(SO4)3]的离子方程式为:H2O2+2H++2Fe2+ 2H2O+2Fe3+。
2H2O+2Fe3+。
 丁(单质)可知,丁为Fe,D(H2SO4)+E(Fe2O3)
丁(单质)可知,丁为Fe,D(H2SO4)+E(Fe2O3) F,则F为Fe2(SO4)3。(1)FeS2高温下燃烧的化学方程式为:4FeS2+11O2
F,则F为Fe2(SO4)3。(1)FeS2高温下燃烧的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2,由此分析可知,每消耗4 mol FeS2,转移电子为44 mol,即每反应1 mol的A(FeS2)转移的电子为11 mol;(2)由转化关系图可知F为Fe2(SO4)3,丁为Fe,G为FeSO4,则有关的离子反应为Fe+2Fe3+
2Fe2O3+8SO2,由此分析可知,每消耗4 mol FeS2,转移电子为44 mol,即每反应1 mol的A(FeS2)转移的电子为11 mol;(2)由转化关系图可知F为Fe2(SO4)3,丁为Fe,G为FeSO4,则有关的离子反应为Fe+2Fe3+ 3Fe2+;(3)将少量饱和Fe2(SO4)3溶液加入①冷水中形成溶液;加入②NaOH溶液中会产生Fe(OH)3沉淀,形成浊液;加入③沸水中会产生Fe(OH)3胶体;(4)化合物M与H(H2O)组成元素相同,则M为H2O2,M在酸性条件下将G(FeSO4)氧化为F[Fe2(SO4)3]的离子方程式为:H2O2+2H++2Fe2+
3Fe2+;(3)将少量饱和Fe2(SO4)3溶液加入①冷水中形成溶液;加入②NaOH溶液中会产生Fe(OH)3沉淀,形成浊液;加入③沸水中会产生Fe(OH)3胶体;(4)化合物M与H(H2O)组成元素相同,则M为H2O2,M在酸性条件下将G(FeSO4)氧化为F[Fe2(SO4)3]的离子方程式为:H2O2+2H++2Fe2+ 2H2O+2Fe3+。
2H2O+2Fe3+。
练习册系列答案
相关题目


 ,下列说法不正确是
,下列说法不正确是