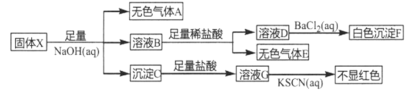
题目内容
【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如下。
![]()
请回答下列问题:
I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如下。
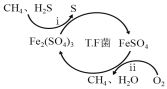
(1)过程i的离子反应方程式为_______________________。
(2)已知:①Fe3+在pH=l.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。
pH | 0.7 | 1.1 | 1.5 | 1.9 | 2.3 | 2.7 |
Fe2+的氧化速/g·L-1·h-1 | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 |
在转化脱硫中,请在上表中选择最佳pH范围是_______<pH<_______,这样选择的原因是:____。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合下图回答问题。
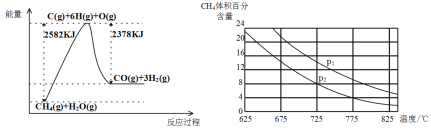
(3)①该过程的热化学方程式是___________。
②比较压强P1和p2的大小关系:P1________P2(选填“>”“<”或“=”)。
③在一定温度和一定压强下的体积可变的密闭容器中充入1mol CH4和1mol的水蒸气充分反应达平衡后,测得起始时混合气的密度是平衡时混合气密度的1.4倍,若此时容器的体积为2L,则该反应的平衡常数为______________(结果保留2位有效数字)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.H2提纯:将CO2和H2分离得到H2的过程如示意图
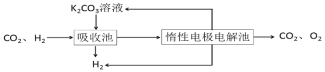
(4)①吸收池中发生反应的离子方程式是______________。
②结合电极反应式,简述K2CO3溶液的再生原理:_____。
【答案】H2S+2Fe3+=2Fe2++S↓+2H+ 1.5 1.9 此范围既保证了Fe2+有较快的氧化速率又防止生成的Fe3+形成沉淀 CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+204kJ/mol > 0.48 CO32-+CO2+H2O=2HCO3- 阴极反应:2H2O+2e-=H2↑+OH-,再发生HCO3-+OH-═CO32-+H2O,使K2CO32-再生
【解析】
(1)过程i为硫化氢与硫酸铁生成硫酸亚铁、S,结合电荷守恒书写可得;
(2)已知Fe3+在pH=1.9时开始沉淀,根据图pH<1.5时,TF菌活性较低,据此可得;
(3)①由图可知,反应为吸热反应,△H=2582kJ/mol-2378kJ/mol=+204kJ/mol,据此书写;
②根据压强对化学平衡的影响分析;
(4)由图可知,吸收池中二氧化碳与碳酸钾溶液的反应得到碳酸氢钾,据此书写。
I.(1)根据图可知过程i为硫化氢与硫酸铁生成硫酸亚铁、S,反应为:H2S+2Fe3+=2Fe2++S↓+2H+;
故答案为:H2S+2Fe3+=2Fe2++S↓+2H+;
(2)由信息可知,当pH>1.9时,Fe3+开始沉淀,导致Fe3+、Fe2+离子浓度均下降,降低反应速率,pH<1.5时,TF菌活性较低,反应速率慢,所以最佳范围为1.51.9,
故答案为:1.5;1.9;此范围既保证了Fe2+有较快的氧化速率又防止生成的Fe3+形成沉淀;
Ⅱ.(3)①由图可知,1mol甲烷、1mol水蒸气生成1molCO和3mol氢气吸收热量(25822378)kJ=204kJ,故热化学方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+204kJ/mol;
故答案为:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+204kJ/mol;
②该反应为气体分子数增大的反应,增大压强,平衡逆向移动,所以相同温度下,压强越大,甲烷的体积分数越大,故P1>P2;
故答案为:>;
③在一定温度和一定压强下的体积可变的密闭容器中充入1molCH4和1mol的水蒸气充分反应达平衡后,测得起始时混合气的密度是平衡时混合气密度的1.4倍,密度之比等于气体体积反比,等于气体物质的量的反比,若此时容器的体积为2L,设消耗甲烷物质的量x,据此计算:
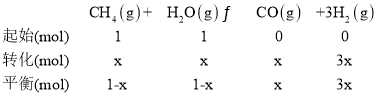
![]() =1.4,x=0.4mol,则平衡时各物质的浓度分别为:c(CH4)=c(H2O)=0.3mol/L,c(CO)=0.2mol/L,c(H2)=0.6mol/L,则该反应的平衡常数K=
=1.4,x=0.4mol,则平衡时各物质的浓度分别为:c(CH4)=c(H2O)=0.3mol/L,c(CO)=0.2mol/L,c(H2)=0.6mol/L,则该反应的平衡常数K=![]() =0.48,
=0.48,
故答案为:0.48;
Ⅳ(4) ①由图可知,吸收池中氢气并未反应,二氧化碳被吸收进入惰性电极电解池,即吸收池中为二氧化碳与碳酸钾溶液的反应,离子方程式为:CO32-+CO2+H2O=2HCO3-;
故答案为:CO32-+CO2+H2O=2HCO3-。
②HCO3存在电离平衡:HCO3H++CO32,阴极H+放电浓度减小平衡右移,CO32-再生,阴极反应:2H2O+2e-=H2↑+OH-,HCO3-+OH-═CO32-+H2O,使碳酸钾溶液得以再生;
故答案为:阴极反应:2H2O+2e-=H2↑+OH-,HCO3-+OH-═CO32-+H2O,使碳酸钾溶液得以再生。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A. 反应达到平衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z
2Z
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 升高温度平衡常数增大,则此反应为吸热反应
【题目】元素单质及其化合物有广泛用途,请回答下列问题:
(1)第三周期元素中,钠原子核外有_______种能量不同的电子;氯原子的最外层电子排布式为______________;由这两种元素组成的化合物的电子式为__________。
(2)下列气体能用浓硫酸干燥的是________。
A.NH3 B.HI C.SO2 D.CO2
(3)请用一个实验事实说明钠与镁的金属性强弱________________________________。
(4)KClO3可用于实验室制O2,若不加催化剂,400 ℃时可分解生成两种盐,化学方程式为:KClO3 ![]() KCl+KClO4 (未配平),则氧化产物与还原产物的物质的量之比为_________。
KCl+KClO4 (未配平),则氧化产物与还原产物的物质的量之比为_________。
(5)已知:
化合物 | MgO | MgCl2 |
类型 | 离子化合物 | 离子化合物 |
熔点/℃ | 2800 | 714 |
工业上电解MgCl2制单质镁,而不电解MgO的原因是________________________________。