题目内容
【题目】根据下列图示所得出的结论正确的是
A.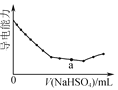 是Ba(OH)2溶液中滴加NaHSO4溶液之后,溶液的导电能力随滴入NaHSO4溶液体积变化的曲线,说明a点对应的溶液呈碱性
是Ba(OH)2溶液中滴加NaHSO4溶液之后,溶液的导电能力随滴入NaHSO4溶液体积变化的曲线,说明a点对应的溶液呈碱性
B.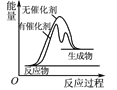 表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化
表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化
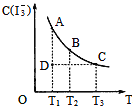
C.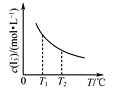 是I2+I-I3-中I3-的平衡浓度随温度变化的曲线,说明平衡常数K(T1)<K(T2)
是I2+I-I3-中I3-的平衡浓度随温度变化的曲线,说明平衡常数K(T1)<K(T2)
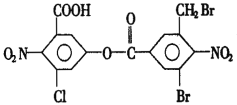
D.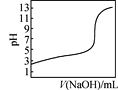 是室温下用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1某酸HX的滴定曲线,说明可用甲基橙判断该反应的终点
是室温下用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1某酸HX的滴定曲线,说明可用甲基橙判断该反应的终点
【答案】A
【解析】
A. Ba(OH)2溶液中滴加NaHSO4溶液之后,溶液中生成硫酸钡沉淀,导电能力减弱,a中硫酸氢钠过量,则溶质为氢氧化钠、硫酸钠,说明a点对用的溶液显碱性,A项正确;
B.该图中反应物能量小于生成物能量,属于吸热反应,B项错误;
C. 由I2+I-I3-中I3-的平衡浓度随温度变化的曲线分析可知,升温平衡逆向进行,平衡常数K(T2)<K(T1),C项错误;
D. 甲基橙的变色范围是3.1-4.4,图象中反应终点的pH不在此范围,不可用甲基橙判断该反应的终点,D项错误;
答案选A。

练习册系列答案
相关题目
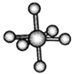
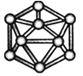
【题目】观察下列模型并结合有关信息进行判断,下列说法错误的是( )
| HCN | S8 | SF6 | B12结构单元 |
结构模型示意图 |
|
|
|
|
备注 | / | 易溶于CS2 | / | 熔点1873 K |
A. HCN的结构式为H—C≡N,分子中“C≡N”键含有1个σ键和2个π键
B. 固态硫S8属于原子晶体,分子中S原子采用sp3杂化
C. SF6是由极性键构成的非极性分子,分子构型为八面体型
D. 单质硼属于原子晶体