题目内容
【题目】下列反应中生成物总能量高于反应物总能量的是( )
A.碳酸钙受热分解B.乙醇燃烧
C.铝粉与氧化铁粉末反应D.氧化钙溶于水
【答案】A
【解析】
吸热反应为生成物的总能量大于反应物的总能量;而放热反应为生成物的总能量小于反应物的总能量。
A.碳酸钙受热分解生成二氧化碳和氧化钙,反应是吸热反应,是生成物的总能量大于反应物的总能量,故A符合题意;
B.乙醇的燃烧反应是一个放热反应,是生成物的总能量小于反应物的总能量,故B不符题意;
C.铝与氧化铁粉未反应是一个放热反应,是生成物的总能量小于反应物的总能量,故C与题意不符;
D.氧化钙溶于水是一个放热反应,是生成物的总能量小于反应物的总能量,故D与题意不符。
故答案:A。

【题目】氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。研究氧化亚氮分解对环境保护有重要意义。
(1)污水生物脱氮过程中,在异养微生物催化下,硝酸铵可分解为N2O和另一种产物,该反应的化学方程式为________。
(2)已知反应2N2O(g)=2N2(g) + O2(g)的ΔH= –163 kJ·mol-1,1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收945 kJ、498 kJ的能量,则1molN2O(g)分子中化学键断裂时需要吸收的能量为________ kJ。
(3)在一定温度下的恒容容器中,反应2N2O(g)=2N2(g) + O2(g)的部分实验数据如下:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
C(N2O)/mol/L | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.010 |
①在0~20min时段,反应速率v(N2O)为________ mol·L-1·min-1。
②若N2O起始浓度c0为0.150 mol·L-1,则反应至30min时N2O的转化率α =__________。比较不同起始浓度时N2O的分解速率:v(c0=0.150 mol·L-1) ________ v(c0=0.100 mol·L-1)(填“>”、“=”或“<”)。
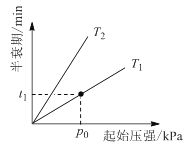
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1________T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1 min时,体系压强p =________(用p0表示)。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g) ![]() 2I(g) (快反应)
2I(g) (快反应)
第二步 I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是________(填标号)。
A.N2O分解反应中,k(含碘)> k(无碘) B.第一步对总反应速率起决定作用
C.第二步活化能比第三步大 D.I2浓度与N2O分解速率无关
【题目】(1)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
物质 | H-H | C=O | C=C | C-H | H-O |
能量/kJmol-1 | 436 | 745 | 615 | 413 | 463 |
则△H=_____________________。
(2)工业上常用电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为2:1。

①气体甲的化学式____________ 。
②a极与电源的____________ (填“正极”或“负极”)相连,该电极反应式为_______________。
③离子交换膜d为________(填“阴离子”或“阳离子”)交换膜。
④产物丙为_________ 溶液。

