题目内容
硫?碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2=H2SO4+2HI
Ⅱ.2HI H2↑+I2
H2↑+I2
Ⅲ.2H2SO4=2SO2+O2↑+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2的物质的量随时IP间的变化如图所示。
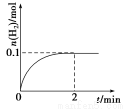
①0~2 min内的平均反应速率v(HI)= 。
②相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.HI的平衡浓度
b.达到平衡的时间
c.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,若加入少量下列固体试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(1)c (2)0.1 mol·L-1·min-1 64 a (3)b
【解析】(1)H2SO4沸点较高,在常温下不发生分解;反应Ⅰ中SO2的还原性比HI强;循环过程中H2O分解生成了H2与O2,需补充;循环过程中产生1 mol O2同时产生2 mol H2,c正确。
(2) 2HI(g)  H2(g) + I2(g)
H2(g) + I2(g)
初始:1 mol·L-1 0 0
平衡:0.8 mol·L-1 0.1 mol·L-1 0.1 mol·L-1
v(HI)=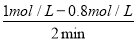 =0.1 mol·L-1·min-1
=0.1 mol·L-1·min-1
该温度下,开始加入HI(g)的物质的量是原来的2倍,平衡常数不变,HI、H2、I2平衡浓度均为原来的2倍,初始浓度变大、反应速率加快,HI、H2、I2的体积分数均不变,故选a。
(3)a、c对反应无影响,b项Zn置换出Cu,形成Cu?Zn原电池,反应速率增大,d使反应速率变慢。

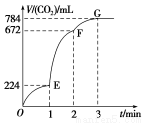
在100 ℃时,将0.40 mol二氧化氮气体充入2 L密闭容器中,每隔一段时间对该容器内
的物质进行分析,得到如下数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
下列说法中正确的是( )
A.反应开始20 s内以二氧化氮表示的平均反应速率为0.001 25 mol·L-1·s-1
B.80 s时混合气体的颜色与60 s时相同,比40 s时的颜色深
C.80 s时向容器中加入0.32 mol氦气,同时将容器扩大为4 L,则平衡将不移动
D.若起始投料为0.20 mol N2O4,相同条件下达平衡,则各组分含量与原平衡体系对应相等