题目内容
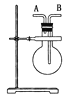
【题目】(I)小明同学想通过比较两种最高价氧化物水化物的酸性强弱来验证S与C的非金属性的强弱,他查阅了资料:可以利用强酸制备弱酸的原理来判断酸性强弱。于是小明采用了下图所示的装置进行实验。请回答:

(1)仪器A的名称是________,应盛放下列药品中的__________。
a.稀硫酸 b.亚硫酸 c.氢硫酸 d.盐酸
(2)仪器B的名称是________,应盛放下列药品中的__________。
a.碳酸钙 b.硫酸钠 c.氯化钠 d.碳酸钠
(3)仪器C中盛放的药品是澄清石灰水,如果看到的现象是澄清石灰水变浑浊,证明B中发生反应生成了_____________,即可说明H2SO4 比H2CO3 酸性强,非金属性S比C强,B中发生反应的离子方程式为______________________________。
(II)(1)用电子式表示下列化合物的形成过程:
CaF2:_____________________________________________
H2S:______________________________________________
(2)有下列物质:①NaOH ②I2 ③MgCl2 ④Na2O2 ⑤氩气 回答下列问题:
①不存在化学键的是_________________________,
②既存在离子键又存在极性键的是__________________。
【答案】分液漏斗 a 圆底烧瓶 d CO32-+2H+=H2O+CO2↑ CO2 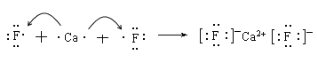
![]() ⑤ ①
⑤ ①
【解析】
(I)比较非金属性的强弱,可根据最高价氧化物的水化物的酸性强弱比较,本题可用稀硫酸与碳酸钠反应验证,C中为澄清石灰水,如变浑浊,则说明生成二氧化碳,可证明硫与碳的得电子能力的强弱;
(II)(1)CaF2是离子化合物,有钙离子和氟离子以离子键结合形成;H2S是共价化合物,有氢原子和硫原子以共价键结合形成;
(2)根据物质的组成和微粒间作用力分析判断各物质的化学键。
(I)(1)比较非金属性的强弱时用的是最高价氧化物的水化物,A仪器名称是分液漏斗,因此在分液漏斗中盛放的是稀硫酸,在圆底烧瓶中盛放的是碳酸盐,答案选a;
(2) B名称是圆底烧瓶,碳酸钙与稀硫酸反应生成的硫酸钙是一种微溶物,会附着在碳酸钙的表面,将阻止反应的进行,所以选取的碳酸钠为反应物,答案选d;
(3)只要证明圆底烧瓶中有二氧化碳生成,就能说明硫酸的酸性比碳酸的酸性强,即说明硫的非金属性比碳强,因此要用澄清石灰水检验二氧化碳的生成,现象是澄清石灰水变浑浊,所以C中试剂是澄清石灰水,B中发生的反应为CO32+2H+═CO2↑+H2O;
(II)(1)CaF2是离子化合物,有钙离子和氟离子以离子键结合形成,形成过程为: ;H2S是共价化合物,有氢原子和硫原子以共价键结合形成,形成过程为:
;H2S是共价化合物,有氢原子和硫原子以共价键结合形成,形成过程为:![]() ;
;
(2)①氢氧化钠中含有钠离子和氢氧根,两种离子间形成离子键,氢氧根中氢原子和氧原子间形成极性共价键,所以氢氧化钠中既存在离子键又存在极性键;
②碘单质为非金属单质,由非金属元素形成的双原子分子,碘原子间形成非极性共价键;
③氯化镁中只含有氯离子和镁离子,只有离子键,不存在共价键;
④过氧化钠中含有钠离子和过氧根离子,过氧根离子中两个氧原子形成非极性共价键,所以过氧化钠中既存在离子键又存在非极性键;
⑤氩气分子为稀有气体单质分子,只存在分子间作用力,不存在化学键;
则不存在化学键的是⑤,既存在离子键又存在极性键的是①。

 名校课堂系列答案
名校课堂系列答案【题目】化合物G的合成路线如下:
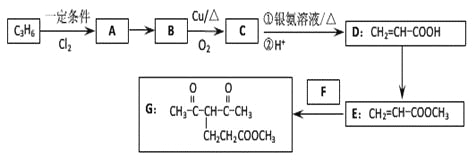
(1)D中含氧官能团的名称为_________,1 molG发生加成反应最多消耗_______mol H2 。
(2)去掉E中含有少量D的试剂和操作是________________________________________;下列有关E的说法正确的是_____________(填字母序号)。
A.可发生氧化反应 | B.催化条件下可发生缩聚反应 |
C.可发生取代反应 | D.是CH2=CHCOOCH2CH3的同系物 |
E.易溶于水
(3)写出A→B的化学反应方程式:________________________________________
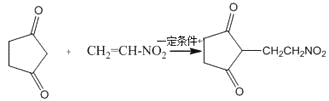
(4)反应E + F→G属于下列麦克尔加成反应类型,则F的结构简式为______________________。
(5)比G少2个氢原子的物质具有下列性质:任写一种该物质的结构简式_________________。
①遇FeCl3溶液显紫色; ②苯环上的一氯取代物只有一种;
③1mol物质最多可消耗2mol Na和1mol NaOH。
【题目】影响化学反应速率的因素很多,某化学小组用实验的方法进行探究。
Ⅰ.探究一:备选药品:镁片、铝片、0.500 mol·L-1H2SO4、18.4 mol·L-1H2SO4。
甲同学研究的实验报告:
实验步骤 | 现象 | 结论 |
①用砂纸打磨镁片和铝片; ②分别取等体积等浓度的硫酸于两支试管中; ③将镁片和铝片同时投入到试管中。 | 金属的性质越活泼, 反应速率越快 |
(1)甲同学用砂纸打磨镁片和铝片的原因是______________________________;选择H2SO4浓度为________________。
(2) 实验报告中现象为_______________________________________________。
Ⅱ.探究二:实验室经常用Na2S2O3与H2SO4的反应探究化学反应速率的影响因素,利用图1所示装置(夹持装置略去)进行实验,观察到锥形瓶底部有淡黄色浑浊。
(3)请用化学方程式表示出实验原理_________________________________,乙同学在实验过程中对产生的气体进行收集,并在2min内6个时间点对注射器内气体进行读数,记录数据并绘制出图像(如图2)。

0~20s内反应速率υ1=__________mL·s-1,80~100s内反应速率υ2=__________mL·s-1。不考虑实验测量误差,分析速率差异的主要原因是_____________。