题目内容
 如图装置实验,A、B两烧杯分别盛放200g10%KOH和足量CuSO4溶液.通电一段时间后,c极增重3.2g.
如图装置实验,A、B两烧杯分别盛放200g10%KOH和足量CuSO4溶液.通电一段时间后,c极增重3.2g.请回答下列问题:
(1)电源P极为
负
负
极;请写出c极电极反应式:Cu2++2e-=Cu
Cu2++2e-=Cu
; (2)b极上产生的气体在标况下的体积为
0.56
0.56
L(3)若装置中用铅蓄电池作电源,已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42-=PbSO4+2e-
正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
假设在a极制得气体0.050mol,这时电池内消耗的H2SO4的物质的量至少是
0.10
0.10
mol.分析:(1)c极增重3.2g,说明c电极是阴极,根据串联电路知,ac是阴极,bd是阳极,P是负极,Q是正极,c电极上铜离子放电生成铜单质;
(2)b电极是阳极,阳极上氢氧根离子放电,根据氧气和转移电子之间的关系式计算;
(3)a电极是阴极,阴极上析出氢气,根据转移电子相等进行计算.
(2)b电极是阳极,阳极上氢氧根离子放电,根据氧气和转移电子之间的关系式计算;
(3)a电极是阴极,阴极上析出氢气,根据转移电子相等进行计算.
解答:解:(1)c极增重3.2g,说明c电极是阴极,根据串联电路知,ac是阴极,bd是阳极,P是负极,Q是正极,c电极上铜离子放电生成铜单质,电极反应式为:Cu2++2e-=Cu;
故答案为:负;Cu2++2e-=Cu;
(2)b电极是阳极,阳极上氢氧根离子放电,根据氧气和转移电子之间的关系式知,生成氧气的体积=
×22.4L/mol=0.56L,
故答案为:0.56;
(3)a电极是阴极,阴极上析出氢气,a极制得氢气0.050mol,转移电子0.10mol,铅蓄电池总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O,则电池内消耗的H2SO4的物质的量至少是0.10mol,
故答案为:0.10.
故答案为:负;Cu2++2e-=Cu;
(2)b电极是阳极,阳极上氢氧根离子放电,根据氧气和转移电子之间的关系式知,生成氧气的体积=
| ||
| 4 |
故答案为:0.56;
(3)a电极是阴极,阴极上析出氢气,a极制得氢气0.050mol,转移电子0.10mol,铅蓄电池总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O,则电池内消耗的H2SO4的物质的量至少是0.10mol,
故答案为:0.10.
点评:本题为电化学知识的综合应用,做题时要注意根据电极反应现象判断出电解池的阴阳级,进而判断出电源的正负极,要注意三个电解池为串联电路,各电极上得失电子的数目相等.

练习册系列答案
相关题目
 如图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).
如图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).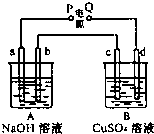 按如图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5g (不考虑水的蒸发).a、b、c为石墨电极,d为铜电极.
按如图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5g (不考虑水的蒸发).a、b、c为石墨电极,d为铜电极.
