题目内容
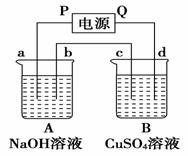
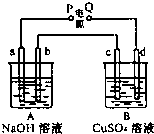 按如图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5g (不考虑水的蒸发).a、b、c为石墨电极,d为铜电极.
按如图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5g (不考虑水的蒸发).a、b、c为石墨电极,d为铜电极.(1)电源P极为
(2)a极上所发生的电极反应式为
(3)标准状况下,b极产生气体的体积为
(4)c极上析出固体的质量为
分析:c极上有Cu析出,说明c为电解池的阴极,d为阳极,则P为负极,Q为正极,A为电解NaOH溶液,实质上为电极水,B为电解硫酸铜溶液,在阴极析出铜,电极反应:Cu2++2e-=Cu,阳极生成氧气,发生4OH--4e-=2H2O+O2↑,结合电极方程式计算.
解答:解:(1)c极上有Cu析出,说明c为电解池的阴极,d为阳极,则P为负极,故答案为:负;
(2)a极电解池的阴极,发生还原反应,生成氢气,电极方程式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(3)被电解的水的质量为4.5g,n(H2O)=
=0.25mol,A总反应式为2H2O
2H2↑+O2↑,由此可知b电极生成氧气0.125mol,标准状况下体积=0.125mol×22.4L/mol=2.8L;
故答案为:2.8L;
(4)b电极为阳极,溶液中氢氧根离子失电子生成氧气,电极反应为4OH--4e-═2H2O+O2↑,依据(3)计算得到氧气为0.125mol,电子转移为0.125mol×4=0.5mol;C电极析出的是铜,由电极反应Cu2++2e-═Cu,计算得到生成铜物质的量为0.25mol,质量=0.25mol×64g/mol=16g;
故答案为:16g.
(2)a极电解池的阴极,发生还原反应,生成氢气,电极方程式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(3)被电解的水的质量为4.5g,n(H2O)=
| 4.5g |
| 18g/mol |
| ||
故答案为:2.8L;
(4)b电极为阳极,溶液中氢氧根离子失电子生成氧气,电极反应为4OH--4e-═2H2O+O2↑,依据(3)计算得到氧气为0.125mol,电子转移为0.125mol×4=0.5mol;C电极析出的是铜,由电极反应Cu2++2e-═Cu,计算得到生成铜物质的量为0.25mol,质量=0.25mol×64g/mol=16g;
故答案为:16g.
点评:本题为电化学知识的综合应用,做题时要注意根据电极反应现象判断出电解池的阴阳级,进而判断出电源的正负极,要注意三个电解池为串联电路,各电极上得失电子的数目相等.做题时要正确写出电极方程式,准确判断两极上离子的放电顺序.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目