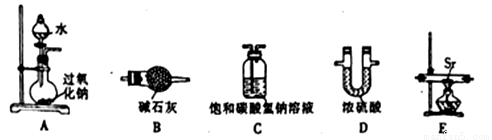
题目内容
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,是浅绿色晶体,可溶于水,在100℃~110℃时分解,常用作定量分析中的标准试剂。某化学小组以废铁屑为原料在实验室中进行实验探究——制备硫酸亚铁铵并检验其纯度,过程如下:
I.制备硫酸亚铁铵

请回答下列问题:
(1)步骤l的作用是_________。(用离子方程式及必要的文字说明);
(2)步骤2中所加硫酸需过量,且不宜等到铁屑完全反应后才过滤,其中蕴含的道理是_______________;
II.测定硫酸亚铁铵的纯度
称取mg实验室制备的硫酸亚铁铵样品,配成500ml溶液,取25. 00mL硫酸亚铁按溶液,用0 . 1mol/L的酸性KMnO4溶液进行滴定,再重复滴定两次。
(3)配制(NH4)2SO4·FeSO4溶液所用的蒸馏水,通常需加热煮沸一段时间后,冷却至室温再使用,这样操作的好处是___________________;
(4)滴定时发生反应的离子方程式为___________________;
(5)滴定终点时的现象为 ___________________;
(6)三次滴定测得酸性KMnO4溶液的用量平均值为VmL,则硫酸亚铁铵样品的纯度为__________;
(7)化学小组分析发现这种检测纯度的方法不够准确,目前处理氮氧化物污染的方法有多种,请你帮助他们设计一种检测方案________________。
下列实验操作、现象和结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | 向A12(SO4)3溶液中滴加过量氨水 | 溶液先浑浊后澄清 | Al(OH)3能溶于氨水 |
B | 将浓硫酸滴在胆矾晶体上 | 蓝色晶体变白 | 浓硫酸具有脱水性 |
C | 将新制的氯水滴在蓝色石蕊试纸上 | 试纸先变红后褪色 | Cl2有漂白性 |
D | 向某晶体的水溶液中加入2滴FeSO4溶液 | 产生特征蓝色沉淀 | 该晶体中一定含有[Fe(CN)6] 3- |
A. A B. B C. C D. D


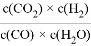 ,K是常数,只与温度有关,与浓度无关。
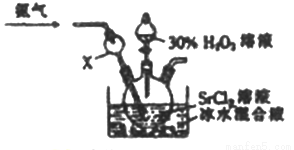
,K是常数,只与温度有关,与浓度无关。 SrO2。某兴趣小组利用下列装置在实验室中模拟制备过氧化锶。
SrO2。某兴趣小组利用下列装置在实验室中模拟制备过氧化锶。