题目内容
将0.2 mol金属R的一种含氧酸盐在隔绝空气的条件下加热,使之完全分解,生成R的氧化物RO和CO、O2的混合气体。已知:该混合气体对氢气的相对密度为18,其体积为8.96 L(标准状况);金属R的原子核中质子数比中子数少4个。测得RO的质量比原含氧酸盐质量减轻一半。通过计算,求出该盐的化学式。
FeC2O4
生成CO、CO2的平均相对分子质量为:18×2=36,混合气体的物质的量为: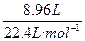 ="0.4" mol,质量为m混="36" g·mol-1×0.4 mol="14.4" g(为含氧酸盐的质量的一半)。
="0.4" mol,质量为m混="36" g·mol-1×0.4 mol="14.4" g(为含氧酸盐的质量的一半)。
设CO的物质的量为x,则CO2的物质的量为0.4-x,有:
28x+44(0.4-x)=14.4
x=0.2
即n(盐)∶n(CO)∶n(CO2)=0.2∶0.2∶0.2=1∶1∶1。
M(盐)= ="144" g·mol-1
="144" g·mol-1
M(RO)="144" g·mol-1-28 g·mol-1-44 g·mol-1="72" g·mol-1
M(R)="72" g·mol-1-16 g·mol-1="56" g·mol-1?故该盐的化学式为FeC2O4。
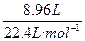 ="0.4" mol,质量为m混="36" g·mol-1×0.4 mol="14.4" g(为含氧酸盐的质量的一半)。
="0.4" mol,质量为m混="36" g·mol-1×0.4 mol="14.4" g(为含氧酸盐的质量的一半)。设CO的物质的量为x,则CO2的物质的量为0.4-x,有:
28x+44(0.4-x)=14.4
x=0.2
即n(盐)∶n(CO)∶n(CO2)=0.2∶0.2∶0.2=1∶1∶1。
M(盐)=
 ="144" g·mol-1
="144" g·mol-1M(RO)="144" g·mol-1-28 g·mol-1-44 g·mol-1="72" g·mol-1
M(R)="72" g·mol-1-16 g·mol-1="56" g·mol-1?故该盐的化学式为FeC2O4。

练习册系列答案
相关题目
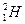 _______________________________。
_______________________________。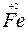 _______________________________。
_______________________________。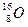 和
和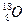 ,它们可分别形成16On和18Om两种气体单质。请完成下列问题:
,它们可分别形成16On和18Om两种气体单质。请完成下列问题:
