题目内容
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,1.4gN2和CO的混合气体含有的电子数为0.7NA
B.标况下,足量Fe在2.24L氯气中燃烧,反应中转移电子的数目为0.3NA
C.1L0.1 mol·Lˉ1 醋酸溶液中含有H+离子的数目为0.1NA
D.18gD2O所含有的质子数,电子数均为10NA
【答案】A
【解析】
试题分析:A.由于N2和CO的摩尔质量均为28g/mol,且所含的电子数均为14,故1.4gN2和CO的混合气体含有的电子数为![]() ,A正确;B. 标况下,足量Fe在2.24L氯气中燃烧,反应中转移电子的数目为0.2NA,B错误;C.醋酸是弱电解质,发生部分电离,因此1L0.1 mol·Lˉ1 醋酸溶液中含有H+离子的数目小于0.1NA,C错误;D. 18gD2O 的物质的量为
,A正确;B. 标况下,足量Fe在2.24L氯气中燃烧,反应中转移电子的数目为0.2NA,B错误;C.醋酸是弱电解质,发生部分电离,因此1L0.1 mol·Lˉ1 醋酸溶液中含有H+离子的数目小于0.1NA,C错误;D. 18gD2O 的物质的量为![]() ,所含的质子数和电子数均为9NA,D错误。故答案A。
,所含的质子数和电子数均为9NA,D错误。故答案A。

 阶梯计算系列答案
阶梯计算系列答案【题目】利用右图所示装置进行下列实验,其中丙中实验现象描述正确的是
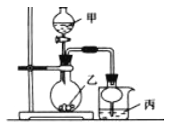
实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
A | 70%硫酸 | Na2SO3 | 紫色石蕊试液 | 溶液先变红后褪色 |
B | 浓盐酸 | KMnO4 | 含酚酞的NaOH溶液 | 溶液褪色 |
C | 稀盐酸 | CaCO3 | BaCI2溶液 | 有白色沉淀生成 |
D | 浓氨水 | CaO | AlCl3 | 先生成白色沉淀然后沉淀溶解 |
A. A B. B C. C D. D
【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
序号 | 反应温度/℃ | C(H2O2)/mol-L | V(H2O2)/mL | M(MnO2)/g | t/min |
1 | 20 | 2 | 10 | 0 | t1 |
2 | 20 | 2 | 10 | 0.1 | t2 |
3 | 20 | 4 | 10 | 0.1 | t3 |
4 | 40 | 2 | 10 | 0.1 | t4 |
(1)设计实验2和实验3的目的是研究_______对化学反应速率的影响。
(2)为研究温度对化学反应速率的影响,可以将实验_____和实验____作对比(填序号)。
(3)将实验1和实验2作对比,t1____t2(填“>”、“<”或“=”)。
II.以KI和FeCl3反应为例(2Fe3++2I-![]() 2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:①0.1mol·L-1KI溶液 ②0.1mol·L-1 FeCl3溶液③0.1mol·L-1 FeCl2溶液 ④0.1mol·L-1 HCl溶液⑤0.1mol·L-1 FeSCN溶液⑥ CCl4
2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:①0.1mol·L-1KI溶液 ②0.1mol·L-1 FeCl3溶液③0.1mol·L-1 FeCl2溶液 ④0.1mol·L-1 HCl溶液⑤0.1mol·L-1 FeSCN溶液⑥ CCl4
实验步骤:
(1)取5mL0.1mol·L-1KI溶液,再滴加几滴0.1mol·L-1 FeCl3溶液
(2)充分反应后,将溶液分成三份;
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
(4)另取一份,加试剂_______(填序号),现象___________,说明此反应存在一定的限度。
【题目】水合碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O],又称轻质碳酸镁。常利用菱镁矿(质量含量为碳酸镁90%,碳酸钙10%)碳化法制取:
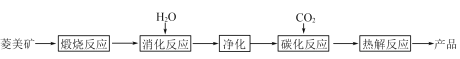
(1)根据下列表格数据,选择消化反应的最佳温度__________;理由是___________________________。
消化温度/℃ | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
转化率/% | 50.3 | 58.2 | 85.1 | 85.2 | 90.7 | 91.2 | 91.5 |
(2)碳化反应可生成Mg(HCO3)2,生成Mg(HCO3)2的化学方程式为____________。
(3)流程图中__________和__________可以为碳化反应提供二氧化碳源。
(4)有工艺设计利用卤水碳化法制取轻质碳酸镁:
①卤水中含有Fe2+和Mn2+,当其浓度小于1×10-5mol·L-1时,可以认为完全除去。常温时当调节溶液PH为9.5时,此时Mn2+小于__________mol·L-1,不会沉淀出来。
物质 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
Ksp | 10-11 | 10-39 | 10-17 | 10-14 |
②如果把Fe2+转化为Fe3+,从环境角度选择最合适的氧化剂为__________。
A.Ca(ClO)2 B.Cl2 C.H2O2 D.HNO3
③下列方案中,较好的为__________,理由是______________________。
![]()